
【题目】下列叙述中,正确的是
A. O2、O3互为同位素B. 1H、2H、3H是三种核素
C. 32He和42He互为同素异形体D. H2O与D2O的组成元素不同
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】根据图示填空

(1)化合物A中含氧官能团的名称是___________________________________。
(2)1mol A与2 mol H2反应生成1 mol E,其反应方程式是__________________________________。
(3)写出A发生加聚反应化学方程式____________________________。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是_________________________。写出D与NaOH溶液反应的化学方程式_________________________________________。
(5)F的结构简式是______________。
(6)写出E发生缩聚反应的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A. 在500℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B. 室温下Ka(HCN) < Ka(CH3COOH),说明CH3COOH电离产生的c(H+)一定比HCN电离产生的c(H+)大
C. 25℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D. 2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用下列装置,进行与氯气相关的实验。
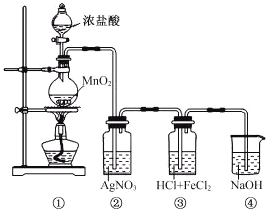
(1)装置④中NaOH溶液的作用是___________。
(2)实验结束后,取装置③中的溶液,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到FeCl3·6H2O晶体。在蒸发浓缩操作中,不需要的仪器是___________。
A.蒸发皿 B.漏斗 C.玻璃棒 D.酒精灯
(3)装置②中出现白色沉淀,据此现象能否推测装置①中生成Cl2___________________,请说明理由_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、H3AsO3和H3AsO4水溶液中含砷的各种微粒的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图所示。

(1)以酚酞为指示剂(变色范围pH8.0 ~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为______。
(2)pH=11时,图中H3AsO3水溶液中三种微粒浓度由大到小顺序为______;
(3)H3AsO4第一步电离方程式为______;
(4)若pKa2=-1gHKa2,H3AsO4第二步电离的电离常数为Ka2,则pKa2=______。
Ⅱ、用0.1000molL-1AgNO3滴定50.00mLL-3Cl-溶液的滴定曲线如图所示

(5)根据曲线数据计算可知Ksp(AgCl)数量级为______;
(6)相同实验条件下,若改为0.0400molL-1Cl-,反应终点c移到______;(填“a”、“b”或“d”)
(7)已知Ksp(AgCl)>Ksp(AgBr),相同实验条件下,若给为0.0500molL-1Br-,反应终点c向______方向移动(填“a”、“b”或“d”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)FeCl3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是:________________________(用离子方程式表示);实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于盐酸中,然后再用蒸馏水稀释到所需的浓度,以______(填“促进”、“抑制”)其水解;将FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是______。
(2)测NaClO溶液的pH,可用__________________(填“广泛pH试纸”、“精密pH试纸”、“pH计”);NaClO溶液显碱性的原因是:________________________(用离子方程式表示);已知HClO的Ka=2.95×10-8,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,则NaClO溶液中通入少量的CO2,所发生的化学方程式为__________。
II.已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系
A.c(Cl-)>c (NH4+)>c (H+)>c(OH-)
B.c (Cl-)>c (NH4+)>c (OH-)>c (H+)
C.c(NH4+)>c (Cl-)>c(OH-)>c (H+)
D.c (Cl-)>c (H+)>c (NH4+)>c (OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,该溶质是_______,上述四种离子浓度的大小顺序为____________(填序号);
(2)若上述关系中C是正确的,则溶质为___________________;若上述关系中D是正确的,则溶质为___________________。
(3)若该溶液是体积相等的浓盐酸和氨水混合而成,且恰好是中性,则混合前c(HCl) _______ c (NH3H2O)(大于、小于或等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】起固氮作用的化学反应的是
A. 工业上用氮气和氢气合成氨气B. 一氧化氮与氧气反应生成二氧化氮
C. 氨气经催化氧化生成一氧化氮D. 由氨气制碳酸氢铵和硫酸铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com