
分析 (1)根据三草酸根合铁(Ⅲ)酸钾的制备方法,溶液中的反应应选用烧杯作反应器;
(2)乙醇与水互溶,而三草酸根合铁(Ⅲ)酸钾难溶于乙醇;
(3)三草酸根合铁(Ⅲ)酸钾的溶解度随温度降低而减小;乙醇挥发带走水分,用乙醇洗涤重结晶产品,也减少了产品损耗;
(4)因三草酸根合铁(Ⅲ)酸钾光照条件下可分解放出CO2;
(5)用高锰酸钾标准溶液滴定至终点时,三草酸根合铁(Ⅲ)酸钾完全反应,此时溶液呈浅红色且半分钟内不再变色;
(6)往滴定后的溶液中加入稀硫酸,再加锌粉,锌置换出氢气,有气泡产生;锌还原三价铁离子,溶液变为浅绿色;
(7)滴定时:3C2O${\;}_{4}^{2-}$~6CO2~6e-~;Fe2+~Fe3+~e-,KMnO4被还原为锰离子,根据电子转移守恒计算.
解答 解:(1)根据三草酸根合铁(Ⅲ)酸钾的制备方法:将12.0g草酸钾晶体溶于20.0mL热的蒸馏水中,在溶液近沸时边搅拌边加入8.0mL FeCl3 水溶液(0.4g/mL),溶液中的反应应选用烧杯作反应器;
故答案为:烧杯;
(2)乙醇与水互溶,而三草酸根合铁(Ⅲ)酸钾难溶于乙醇,可以往溶液中加入少量乙醇,促进三草酸根合铁(Ⅲ)酸钾晶体析出完全;
故答案为:乙醇;
(3)三草酸根合铁(Ⅲ)酸钾的溶解度随温度降低而减小,故用冰蒸馏水洗涤三草酸根合铁(Ⅲ)酸钾晶体,减少减少产品损耗;乙醇挥发带走水分,用乙醇洗涤重结晶产品,也减少了产品损耗;
故答案为:减少产品损耗;利用乙醇挥发带走水分;
(4)因三草酸根合铁(Ⅲ)酸钾光照条件下可分解放出CO2,故称取最终产品配成250mL溶液过程中要注意避光;
故答案为:避光;
(5)用高锰酸钾标准溶液滴定至终点时,三草酸根合铁(Ⅲ)酸钾完全反应,此时溶液呈浅红色且半分钟内不再变色;
故答案为:滴定至溶液呈浅红色且半分钟内不再变色;
(6)往滴定后的溶液中加入稀硫酸,再加锌粉,锌置换出氢气,有气泡产生;锌还原三价铁离子,溶液变为浅绿色;
故答案为:溶液颜色变为浅绿色,产生气泡;
(7)滴定时:3C2O${\;}_{4}^{2-}$~6CO2~6e-,Fe2+~Fe3+~e-,KMnO4被还原为锰离子,根据电子转移守恒则$\overline{{V}_{1}}$:$\overline{{V}_{2}}$=6:1;
故答案为:6:1.
点评 本题考查较为综合,涉及到物质的制备、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题.


科目:高中化学 来源: 题型:选择题
| 元素代号 | 元素性质或原子结构 |
| T | M层上的电子数为6个 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7 |
| A. | 元素X的一种同位素可测定文物年代,这种同位素的符号是12C | |
| B. | 元素Z的非金属性比元素T弱 | |
| C. | Y和T位于同一主族 | |
| D. | T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其它三种的是碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③正确 | B. | 只有③正确 | C. | ①②③④正确 | D. | ①②③正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 组别 | 被提纯物质 | 杂质 | 除杂试剂 | 除杂操作 |
| A | CO2 | SO2 | Na2CO3溶液 | 洗气 |
| B | 乙酸乙酯 | 乙酸 | 乙醇和浓H2SO4 | 加热 |
| C | 乙烷 | 乙烯 | 溴水、碱石灰 | 洗气 |
| D |  | CH3CH2OH | H2O | 分液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 半径(pm) | 30 | 64 | 66 | 91 | 70 | 106 | 110 | 186 | 125 | 232 |
| 主要 化合价 | -1,+1 | -1 | -2 | -4, +4 | -3, +5 | -2,+4,+6 | -4, +4 | +1 | +3 | +1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水的电离方程式:H2O=H++OH- | |
| B. | pH=7的溶液一定是中性溶液 | |
| C. | 升高温度,水的电离程度增大 | |
| D. | 将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大c(X),X的转化率增大 | B. | 降低温度,Y的转化率增大 | ||
| C. | 减小容器体积,平衡向右移动 | D. | 加入催化剂,Z的产率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
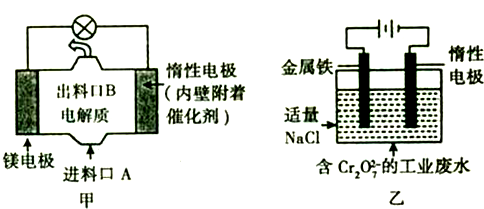
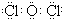 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、钾着火时用水灭火 | |
| B. | 点燃氢气前要验纯,点燃甲烷前不必验纯 | |
| C. | 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上浓硫酸 | |
| D. | 稀释浓硫酸时,为防止液体飞溅,将浓硫酸沿烧杯壁缓缓加入水中,并不断搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com