
| A、该电池的电池反应式为:2Li+FeS═Li2S+Fe |
| B、Li-Al合金在电池中作为正极材料 |
| C、负极的电极反应式为:Al-3e-═Al3+ |
| D、Li-Al/FeS电池中,电子经外电路流入Li-Al极 |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
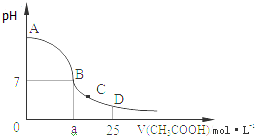 现有常温下的六份溶液:
现有常温下的六份溶液:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①<②<③<④ |
| B、②<①<③<④ |
| C、②<①<④<③ |
| D、①<②<④<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用CaCl2溶液可区别Na2C03和NaHCO3溶液 |
| B、用CC14萃取碘水中的碘 |
| C、用饱和NaHCO3溶液除去C02中的HCl |
| D、检验未知溶液是否含S042-,可先加氯化钡,再加稀盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com