
【题目】运用有关概念判断下列叙述正确的是( )
A.能够完全电离的电解质称为强电解质,如硫酸、盐酸、氢氧化钠等是强电解质
B.1mol甲烷燃烧放出的热量为甲烷的燃烧热
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.风能是正在探索的新能源之一,它是太阳能的一种转换形式,具有不稳定
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】I.由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
(1)写出Fe2+的核外电子排布式 .
(2)下列说法正确的是 .
a.H2S、O3分子都是直线形
b.BF3和NH3都是含有极性键的非极性分子
c.CO2、HCN分子的结构式分别是:O=C=O、H﹣C≡N
d.CH3COOH分子中碳原子的杂化方式有:sp2、sp3
(3)NO是人体中的信号分子,有关说法正确的 .
a.原子半径N大于O b.非金属性O大于N
c.NO+的结构式为:〔N≡O〕+ d.NO形成的晶体是分子晶体
(4)TiO2的天然晶体中,最稳定的一种晶体结构如图1,白球表示原子.
(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构: .
(6)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合
物,实验室测定铁的含量:可用配位剂邻二氮菲
( ![]() ),它能与Fe2+形成红色配合物(如右图2),
),它能与Fe2+形成红色配合物(如右图2),
该配离子中Fe2+与氮原子形成配位键共有个.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
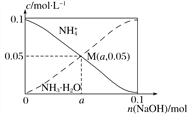
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上产生的氮氧化物可用天然气来处理.
(1)Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△ H=(用△ H1、△ H2、△ H3)
(2)Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
①分析上表中数据,下列说法正确的是
A.T1℃ 前10min,V(NO2)=0.03mol/(Lmin)
B.T1℃ 反应达化学平衡状态时,CH4的转化率为80%
C.T2℃ 反应在40min时处于平衡状态
D.T1>T2
②反应的平衡常数K(T1) K(T2),△H0,理由是 .
③T1℃时反应的平衡常数K为 .
④反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2 , 在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4) .
(3)Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为ρ g/ml,质量分数为w,物质浓度为cmol/L,则下列关系中不正确的是( )
A.ρ= ![]()
B.W= ![]()
C.W= ![]()
D.C= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、D、X、Y、Z,基态时核外电子排布具有以下特征:A的电子层数和最外层电子数相等,非金属元素B的已成对电子数是未成对电子数的2倍,且A和B位于不同周期;D和X的价电子层中未成对电子均只有1个,并且D﹣和X+的电子相差为8;Y、Z与X位于同一周期,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2.回答下列问题:
(1)Z2+的价层电子排布式为 .
(2)D、X、Y三种元素中第一电离能从大到小的顺序是 . (填元素符号)
(3)分子式为AD的化合物常以多聚体(AD)n的形式存在,请解释原因 .
(4)B和氮原子可形成化合物(BN)2 , (BN)2分子中中心原子的杂化方式为 , φ键和π键的个数之比为 , 空间构型为 .
(5)D﹣、X+、Y3+三种离子组成的化合物X3YD6 , 其中化学键的类型有;该化合物中存在一个复杂离子,该离子的化学式为 , 配位体是 .
(6)Y晶体的晶胞如图所示,晶胞边长为apm,则Y的配位数为 , 晶体的密度为g/cm3 . (用NA 表示阿伏伽德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙烯、甲苯、甲基丙烯(E)三种原料合成高分子药物M和有机中间体L的路线如下:
已知:
Ⅲ.L是六元环酯,M分子式是(C15H16O6)n
回答下列问题:
(1)D中含氧官能团的名称是 , B的结构简式是 .
(2)E→F的反应条件是 , H→J的反应类型是 .
(3)F→G的化学反应方程式是 .
(4)K→M属于加聚反应,M的结构简式是 .
(5)在NaOH溶液中,K水解的化学反应方程式是 .
(6)写出3个符合下列条件的C的同分异构体的结构简式 .
①属于芳香族化合物;
②能发生银镜反应;
③核磁共振氢谱有4组峰,且峰面积之比为1:1:2:2.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出),请回答下列问题: 
(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为 , 反应④的化学方程式为 .
(2)若A是常见的变价金属的单质,D、F是气态单质,反应④可以在光照条件下发生.反应①和反应②在水溶液中进行,反应②的离子方程式是
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为 . 标准状况下3.36L物质E与含氢氧化钠10.0g的溶液充分反应,所得溶液中溶质成分为(写出化学式和对应的物质的量).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com