
����Ŀ��I���������Ժʿ����Ժʿѧ��ͬ���ġ����ӹ��������ն�����������ˣ�ȫ������������Ϸ˵��BF3��TiO2��CH3COOH��CO2��NO����ï����NH3��HCN��H2S��O3�������ϩ���Ƶ��ڶࡰ���ӹ������е����ǣ�
��1��д��Fe2+�ĺ�������Ų�ʽ ��
��2������˵����ȷ���� ��
a��H2S��O3���Ӷ���ֱ����
b��BF3��NH3���Ǻ��м��Լ��ķǼ��Է���
c��CO2��HCN���ӵĽṹʽ�ֱ��ǣ�O=C=O��H��C��N
d��CH3COOH������̼ԭ�ӵ��ӻ���ʽ�У�sp2��sp3
��3��NO�������е��źŷ��ӣ��й�˵����ȷ�� ��
a��ԭ�Ӱ뾶N����O b���ǽ�����O����N
c��NO+�ĽṹʽΪ����N��O��+ d��NO�γɵľ����Ƿ��Ӿ���
��4��TiO2����Ȼ�����У����ȶ���һ�־���ṹ��ͼ1�������ʾԭ�ӣ�
��5�������۷е�ܸߣ������ڴ����Է��Ӽ�����ϵĶ����壨��һ����״�ṹ�����뻭���������Ľṹ�� ��
��6����ï����C5H5��2Fe��Fe2+�뻷���ϩ���γɵ�һ�����
�ʵ���Ҳⶨ���ĺ�����������λ���ڶ�����
�� ![]() ����������Fe2+�γɺ�ɫ��������ͼ2����
����������Fe2+�γɺ�ɫ��������ͼ2����
����������Fe2+�뵪ԭ���γ���λ����������
���𰸡�
��1��[Ar]3d6
��2��cd
��3��abcd
��4��O
��5��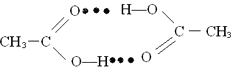
��6��6
���������⣺��1������26��Ԫ�أ���ԭ�Ӻ�����26�����ӣ���ԭ��ʧȥ2�����ӱ�ΪFe2+ �� ���ݹ���ԭ��֪�������Ӻ�������Ų�ʽΪ[Ar]3d6 ��
���Դ��ǣ�[Ar]3d6����2��a��H2S��O3���Ӷ���V�Σ��ʴ���b��BF3��NH3���Ǻ��м��Լ�����ǰ���ǷǼ��Է��ӣ��������Ǽ��Է��ӣ��ʴ���c��CO2��HCN���ӵĽṹʽ�ֱ��ǣ�O=C=O��H��C��N������ȷ��d��CH3COOH������̼ԭ�ӵļ۲���Ӷ����ֱ�Ϊ4��3�������ӻ���ʽ�У�sp3��sp2 �� ����ȷ����ѡcd����3��a��ͬһ����Ԫ�أ�ԭ�Ӱ뾶����ԭ���������������С������ԭ�Ӱ뾶N����O������ȷ��b��ͬһ����Ԫ�أ�Ԫ�صķǽ���������ԭ���������������ǿ�����Էǽ�����O����N������ȷ��c���������Ӻ��ǵȵ����壬�ȵ�����ṹ���ƣ��Ե������ӵĽṹ֪NO+�ĽṹΪN��O+ �� ����ȷ��d�����Ӿ���Ĺ������Ƿ��ӣ�NO�γɵľ��幹������NO���ӣ�����NO�������ڷ��Ӿ��壬����ȷ����ѡabcd����4���������=2+4�� ![]() =4���������=1+8��
=4���������=1+8�� ![]() ��������ͺ��������Ϊ2��1�����ݶ�������Ļ�ѧʽ֪�������ʾ��ԭ�ӣ����Դ��ǣ�O����5������������Ӽ��У��Ȼ��ϵ���ԭ������һ�����������̼��˫������ԭ���γ�����������������ʾΪ
��������ͺ��������Ϊ2��1�����ݶ�������Ļ�ѧʽ֪�������ʾ��ԭ�ӣ����Դ��ǣ�O����5������������Ӽ��У��Ȼ��ϵ���ԭ������һ�����������̼��˫������ԭ���γ�����������������ʾΪ 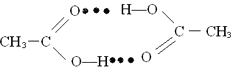 �����Դ��ǣ�
�����Դ��ǣ� 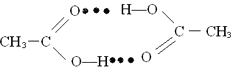 ����6����������������������ӣ��ṩ�չ������ԭ���ṩ�µ��Ӷԣ�����ͼ֪����λ��������6�����Դ��ǣ�6��
����6����������������������ӣ��ṩ�չ������ԭ���ṩ�µ��Ӷԣ�����ͼ֪����λ��������6�����Դ��ǣ�6��


 ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᣨH3BO3������Ӧ���ڲ���������ҵ������þ��2MgOB2O3H2O��SiO2������Fe3O4��CaCO3��Al2O3��Ϊԭ����������Ĺ���������ͼ�� 
��֪��i��Fe3+��Al3+��Fe2+��Mg2+������������ʽ��ȫ����ʱ����Һ��pH�ֱ�Ϊ3.2��5.2��9.7��12.4��
����H3BO3��20�桢40�桢60�桢100��ʱ���ܽ������Ϊ5.0g��8.7g��14.8g��40.2g��
��1��Ϊ�������þ��۵Ľ����ʣ��ɲ�ȡ�Ĵ�ʩ�������ٴ���������
��2��������Һ�������ԣ���H3BO3��Mg2+��SO42�� �� ������Fe3+��Fe2+��Ca2+��Al3+�����ʣ������ӡ�ʱ�����Һ�����μ�������H2O2��MgO��H2O2���������������ӷ���ʽ��ʾ����MgO��ȥ������������ ��
��3����֪H3BO3�������NaOH��Ӧ����Na[B��OH��4]����д��H3BO3����Һ�еĵ��뷽��ʽ ��
��4������ȡ�����á��ȹ��ˡ���Ŀ���� �� ĸҺ�е���Ҫ������ ��
��5���ⶨ���ò�Ʒ�Ĵ��ȣ�ȡa g���ᣬС�ļ���ʹ��ֽ���ȥˮ�֣��������Ȳ��ֽ⣩���ò�������b g�����Ʒ�Ĵ���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ�õ������������ʵ��Ҫ����ǣ� ��
A | B | C | D |
���Ũ���� | ����ˮ���������� | ȷ��ȡ9.50mLˮ | ʵ������ȡ��ϩ |
|
|
|
|
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ���÷�������ȡ���������壬��֪���������������ҺpH��ϵ��ͼ��ʾ��
ʵ���п�ѡ�õ��Լ����ٴ���������������2.0molL��1�����2.0molL��1NaOH��Һ��
�������Ʊ������������ʵ�鲽������Ϊ��
�ٳ�ȡһ���������������ձ��У��ִμ���2.0molL��1NaOH��Һ�����������ٲ�������Ϊֹ��
�ڹ��ˣ�
�� ��
�ܹ��ˡ�ϴ�ӣ�
�� ��
������Ũ����
����ȴ�ᾧ��
����ˡ�ϴ�ӡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����á�863���ƻ�֧�ֵĻ����Ѻ��������������Ƴɹ����������ҺΪAlI3��Һ������ܷ�ӦʽΪ2Al+3I2�T2AlI3 �� ����˵������ȷ���ǣ� ��
A.�õ�ظ����ĵ缫��ӦΪ��Al��3e��=Al3+
B.��ع���ʱ����Һ���������������ƶ�
C.������ͬ��������ʱ������������������ӵ����ʵ���������ʱ��
D.����������3.612��1024������ͨ��ʱ����ظ�����������27g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����ͨ��ʵ�鷽����֤Fe2+��ijЩ���ʣ�
��1����ʵ��ǰ������Fe2+���ԣ���д�������
ʵ����� | Ԥ������ | ��Ӧ�����ӷ���ʽ |
��ʢ���¸�FeSO4��Һ���Թ��е�������Ũ���ᣬ�� | �Թ��в�������ɫ���壬��Һ��ɫ��� | Fe2++NO3��+2H+=Fe3++NO2��+H2O |
���ձ��в�������С�����ʵ�飮�۲쵽Һ���Ϸ�������Ϊ����ɫ�����Թ�����Һ��ɫȴ��Ϊ����ɫ��
��2���ֱ�ȡ������Ӧ�����Һ����ֻ�Թ��У�һֻ�μӼ���KSCN��Һ����Һ��Ϊ��죬����Һ�к�������һֻ�ԹܵμӼ�����Һ��������ɫ����������Fe2+ ��
��3����С��������Ϊ����ɫ������NO2��NO������ijһ�����ӷ�����Ӧ����ģ�
������룺
����NO2��Fe2+������Ӧ����NO2 ��Fe3+������Ӧ
����NO��Fe2+������Ӧ����
��4����С������ͼװ�ý���̽���� 
���� | ���������� | ���ͻ���� |
�� | �ر�k��b����a����ʼ���з�Ӧ��һ��ʱ��۲쵽������Һ��Ϊ����ɫ����������Һ�����Ա仯 | ��Һ����ɫ����NO��NO2��Ӧ���ĵõ� |
�� | ֹͣ���з�Ӧ����k��b���ر�a������ͨ��N2һ��ʱ�� | �ò�����Ŀ�� |
�� | �����µı�����װ�ã���ͨһ��ʱ��N2��ر�k��ʹ���з�Ӧ�������۲쵽�������벽�������ͬ | ��ƿ�з����Ļ�ѧ��Ӧ����ʽΪ |
��5�����ʵ����룬�ó����ۣ�
��Һ������ɫ��ԭ�϶��������Dz�������ȷ�����Dz��� �� �д�����ʵ���һ��̽����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������¡���ѧС���ijNa2CO3��NaHCO3�Ļ����Һ�����¼�ơ���Ʒ��Һ��������ɽ���̽����ȡ20.0mL��Ʒ��Һ����������ε���0.10molL��1��ϡ���ᣬ�ߵα����������������Ͳ�����������±���
��Ӧ�� | �� | �� | �� |
�������x/mL | 0��x��10.0 | 10.0��x��40.0 | x��40.0 |
���� | ������ | �������� | ������ |
��ش��������⣺
��1������0.10molL��1��ϡ����250mL����Ҫ10.0molL��1��Ũ��������ΪmL��
��2��������Ʒ��Һ��̼������ӵ����ʵ���Ũ�ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ�����ʽ���ֶ�������ͼ������Ԫ�����ڱ���һ���֣�1��36��Ԫ�أ����Ա���ѧ����Ԫ�����ڱ�˼������Ԫ�����ڱ��������ɣ�����˵����ȷ���ǣ� ��
A.�ڡ��ࡢ���Ӧ�ļ����Ӱ뾶��������
B.���Ȼ�����۵�Ȣߵ��Ȼ����۵��
C.Ԫ�آ�ڳ������ڱ��������ڵ�VIIIB��
D.�ٷֱ���ۡ��ܡ��ݾ����γɼȺ����Լ��ֺ��Ǽ��Լ��ķǼ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йظ����ж�����������ȷ����( )
A.�ܹ���ȫ����ĵ���ʳ�Ϊǿ����ʣ������ᡢ���ᡢ�������Ƶ���ǿ�����
B.1mol����ȼ�շų�������Ϊ�����ȼ����
C.�кͷ�Ӧ�����κ�ˮ���ɣ����κ�ˮ���ɵķ�Ӧ�������кͷ�Ӧ
D.����������̽��������Դ֮һ������̫���ܵ�һ��ת����ʽ�����в��ȶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com