
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
A.②、⑧、⑨对应的简单离子半径依次增大
B.⑥的氯化物的熔点比⑦的氯化物熔点高
C.元素⑩处于常见周期表第四周期第VIIIB族
D.①分别与③、④、⑤均可形成既含极性键又含非极性键的非极性分子
科目:高中化学 来源: 题型:
【题目】下列各物质的转化关系如下图所示,A是一种高熔点金属氧化物,D是一种红棕色固体.
回答下列问题:
(1)填写下列物质的化学式:A;B;D;H .
(2)写出下列反应的方程式:①C+D→A+E的化学方程式: .
②A→H的离子方程式: .
③F→G的化学方程式:、 .
(3)F→G反应现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
(1)写出Fe2+的核外电子排布式 .
(2)下列说法正确的是 .
a.H2S、O3分子都是直线形
b.BF3和NH3都是含有极性键的非极性分子
c.CO2、HCN分子的结构式分别是:O=C=O、H﹣C≡N
d.CH3COOH分子中碳原子的杂化方式有:sp2、sp3
(3)NO是人体中的信号分子,有关说法正确的 .
a.原子半径N大于O b.非金属性O大于N
c.NO+的结构式为:〔N≡O〕+ d.NO形成的晶体是分子晶体
(4)TiO2的天然晶体中,最稳定的一种晶体结构如图1,白球表示原子.
(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构: .
(6)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合
物,实验室测定铁的含量:可用配位剂邻二氮菲
( ![]() ),它能与Fe2+形成红色配合物(如右图2),
),它能与Fe2+形成红色配合物(如右图2),
该配离子中Fe2+与氮原子形成配位键共有个.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质或应用的说法正确的是
A. 医疗上,常用碳酸钠治疗胃酸过多
B. 在海轮外壳上安装锌块以减缓船体腐蚀
C. 液氨汽化放出大量的热,可用作制冷剂
D. 明矾具有强氧化性,常用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法中正确的是
A. 化学反应速率可用某时刻生成物的物质的量来表示
B. 在同一反应中,用反应物或生成物表示的化学反应速率的值是相等的
C. 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加
D. 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.电解质溶液导电为化学变化
B.Na、SiO2、H2O都称为分子式
C.NH3的水溶液能导电,所以NH3为电解质
D.HClO、KNO3、H2O2中均含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
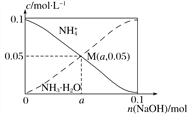
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上产生的氮氧化物可用天然气来处理.
(1)Ⅰ.已知:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
N2(g)+2O2(g)=2NO2(g)△H2
H2O(l)=H2O(g)△H3
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△ H=(用△ H1、△ H2、△ H3)
(2)Ⅱ.在温度为T1℃和T2℃时,分别将0.50molCH4和1.2molNO2充入体积固定的2L密闭容器中,发生上述可逆反应,测得不同时刻的n(CH4)数据如下表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1℃ | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2℃ | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 | 0.15 |
①分析上表中数据,下列说法正确的是
A.T1℃ 前10min,V(NO2)=0.03mol/(Lmin)
B.T1℃ 反应达化学平衡状态时,CH4的转化率为80%
C.T2℃ 反应在40min时处于平衡状态
D.T1>T2
②反应的平衡常数K(T1) K(T2),△H0,理由是 .
③T1℃时反应的平衡常数K为 .
④反应在T1℃下进行,50min时,向平衡后的容器中再通入0.10molCH4和0.40molNO2 , 在下图中画出恒温,重新达到平衡过程中n(CH4)随时间变化的曲线(只要求画出n(CH4)的变化趋势,不需要准确画出再次平衡后n(CH4) .
(3)Ⅲ.NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图.该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com