
【题目】“创新”化学小组对某Na2CO3和NaHCO3的混合溶液(以下简称“样品溶液”)的组成进行探究,取20.0mL样品溶液,向其中逐滴滴入0.10molL﹣1的稀盐酸,边滴边振荡,滴入盐酸的体积和产生的现象见下表.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现象 | 无气体 | 产生气体 | 无气体 |
请回答下列问题:
(1)配制0.10molL﹣1的稀盐酸250mL,需要10.0molL﹣1的浓盐酸的体积为mL.
(2)计算样品溶液中碳酸根离子的物质的量浓度.
【答案】
(1)2.5
(2)当加入10mL稀盐酸时,恰好把样品中的碳酸根离子完全转化为碳酸氢根离子,10mL稀盐酸的物质的量为0.010L×0.10mol/L=0.001mol;
设20.0mL样品溶液中碳酸根离子的物质的量为y则:
CO ![]() +H+HCO
+H+HCO ![]()
1 1
y 0.001mol
解得y=0.001mol,则样品中碳酸根离子物质的量浓度C= ![]() =0.05mol/L;
=0.05mol/L;
故答案为:0.05mol/L
【解析】解:(1)配制0.10molL﹣1的稀盐酸250mL设需要浓盐酸的体积为V,则依据溶液稀释过程中所含溶质的物质的量不变得:V×10.0mol/L=0.10mol/L×250mL,解得V=2.5mL;所以答案是:2.5mL;


科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列有关叙述不正确的是( )
A.在熔融状态下,1 mol Na2O2 完全电离出的离子数目为3 NA
B.将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数 ![]()
C.在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10NA
D.含1mol Cl﹣的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH![]() 数为 NA
数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物J具有抗缺血性脑损伤的作用,合成J的一种路线如图: 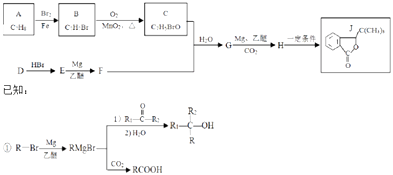
②E的核磁共振氢谱只有一组峰
③C能发生银镜反应
回答下列问题:
(1)D所含有官能团的名称 .
(2)由D生成E的化学方程式为 , 其反应类型为 .
(3)G的结构简式为 .
(4)C的某同系物X,相对分子质量比C大14,X的结构有种,其中核磁共振氢谱为4组峰,且锋面积比为1:2:2:2的是(写结构简式).
(5)由甲醛和化合物A经下列步骤可得到2﹣苯基乙醇. ![]()
反应条件1为;反应条件2所选择的试剂为;L的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.由徐光宪院士发起,院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、CH3COOH、CO2、NO、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
(1)写出Fe2+的核外电子排布式 .
(2)下列说法正确的是 .
a.H2S、O3分子都是直线形
b.BF3和NH3都是含有极性键的非极性分子
c.CO2、HCN分子的结构式分别是:O=C=O、H﹣C≡N
d.CH3COOH分子中碳原子的杂化方式有:sp2、sp3
(3)NO是人体中的信号分子,有关说法正确的 .
a.原子半径N大于O b.非金属性O大于N
c.NO+的结构式为:〔N≡O〕+ d.NO形成的晶体是分子晶体
(4)TiO2的天然晶体中,最稳定的一种晶体结构如图1,白球表示原子.
(5)乙酸熔沸点很高,是由于存在以分子间氢键缔合的二聚体(含一个环状结构),请画出这二聚体的结构: .
(6)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基形成的一类配合
物,实验室测定铁的含量:可用配位剂邻二氮菲
( ![]() ),它能与Fe2+形成红色配合物(如右图2),
),它能与Fe2+形成红色配合物(如右图2),
该配离子中Fe2+与氮原子形成配位键共有个.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关溴乙烷的下列叙述中,正确的是( )
A.在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成
B.溴乙烷不溶于水,能溶于大多数有机溶剂
C.溴乙烷与NaOH的醇溶液反应,可生成乙醇
D.溴乙烷通常用溴与乙烷直接反应来制取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质或应用的说法正确的是
A. 医疗上,常用碳酸钠治疗胃酸过多
B. 在海轮外壳上安装锌块以减缓船体腐蚀
C. 液氨汽化放出大量的热,可用作制冷剂
D. 明矾具有强氧化性,常用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法中正确的是
A. 化学反应速率可用某时刻生成物的物质的量来表示
B. 在同一反应中,用反应物或生成物表示的化学反应速率的值是相等的
C. 化学反应速率是指反应进行的时间内,反应物浓度的减少或生成物浓度的增加
D. 可用单位时间内氢离子物质的量浓度的变化来表示氢氧化钠和硫酸的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 L 0.1 mol·L-1 NH4Cl溶液中,不断加入固体NaOH后,NH![]() 与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
与NH3 · H2O的变化趋势如下图所示(不考虑体积变化和氨的挥发),下列说法不正确的是( )
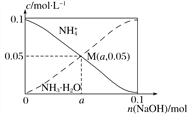
A. 在M点时,n(OH-)-n(H+)=(a-0.05) mol
B. 随着NaOH的加入,![]() 不断增大
不断增大
C. M点溶液中水的电离程度比原溶液小
D. 当n(NaOH)=0.1 mol时,c(OH-)>c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙烯、甲苯、甲基丙烯(E)三种原料合成高分子药物M和有机中间体L的路线如下:
已知:
Ⅲ.L是六元环酯,M分子式是(C15H16O6)n
回答下列问题:
(1)D中含氧官能团的名称是 , B的结构简式是 .
(2)E→F的反应条件是 , H→J的反应类型是 .
(3)F→G的化学反应方程式是 .
(4)K→M属于加聚反应,M的结构简式是 .
(5)在NaOH溶液中,K水解的化学反应方程式是 .
(6)写出3个符合下列条件的C的同分异构体的结构简式 .
①属于芳香族化合物;
②能发生银镜反应;
③核磁共振氢谱有4组峰,且峰面积之比为1:1:2:2.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com