
【题目】请找出下列图示中正确的实验操作( )
A. 除去CO的CO2 B. 萃取时振荡混合液
B. 萃取时振荡混合液
C. 稀释浓硫酸 D. 向试管中滴加液体
D. 向试管中滴加液体
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2![]() 2SO3 ΔH< 0,已知常压下平衡混合气体中SO3的体积分数为91%。试回答:
2SO3 ΔH< 0,已知常压下平衡混合气体中SO3的体积分数为91%。试回答:
(1)在生产中常用过量的空气,是为了________________________________;
(2)加热到400 ℃~500 ℃,是由于______________________________________;
(3)压强采用________,原因是__________________________________________________;
(4)常用浓H2SO4来吸收SO3而不用水,是因为__________________________________________;
(5)尾气中的SO2必须回收,是为了_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率而加入MnO2
D.降温加快H2O2的分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:①有氧气生成;②____________。Na2O2跟水反应的化学方程式是____________。
(2)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是_________;用以验证第二条结论的实验方法是________。

(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为____。
(4)将Cl2制成漂白粉的主要目的是________(填字母)。
A.增强漂白能力和消毒作用
B.使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D.提高氯的质量分数,有利于漂白、消毒
(5)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的化学方程式为_________。
(6)瓶装漂白粉久置空气中会呈稀粥状而失去漂白作用。试用化学方程式表示漂白粉在空气中易失效的原因是①_____________;②__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.用水鉴别乙醇、苯和溴苯
B.用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯
C.橡胶、蛋白质、尼龙、纤维素都是天然高分子化合物
D.通常所说的三大合成材料是指塑料、合成纤维和合成橡胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Cl2(g)![]() 2HCl(g)的反应能量变化示意图如下。下列说法不正确的是
2HCl(g)的反应能量变化示意图如下。下列说法不正确的是

A. 键的断裂过程是吸热过程,键的形成过程是放热过程
B. “假想的中间物质”的总能量高于起始态H2和Cl2的总能量
C. 反应的△H=[(a+b)-2c]kJ/mol
D. 点燃条件和光照条件下,反应的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.02mol/L的NaOH溶液,分别滴定浓度为0.0lmol/L的三种稀酸溶液,滴定的曲线如右图所示,下列判断正确的是

A. 三种酸均为弱酸,且同浓度的稀酸中导电性:HA<HB<HD
B. 滴定至P点时,溶液中:c(HB)>c(B-)
C. 溶液呈中性时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙(黄绿色气体)、丙及物质C 、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
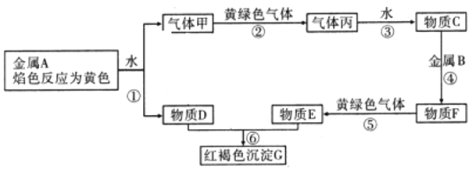
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_______、B_______、G ________
(2)写出反应①的化学方程式__________________________________;反应⑤的离子方程式 ____________________________________;
(3)检验物质E的阳离子可以滴加KSCN,现象为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学反应原理研究N、S氧化物有着重要的意义。
(1)已知:
2SO2(g)+O2(g) ![]() 2SO3(g)ΔH1=-196.6kJ/mol
2SO3(g)ΔH1=-196.6kJ/mol
2NO(g)+O2(g) ![]() 2NO2(g)ΔH2=-113.8kJ/mol
2NO2(g)ΔH2=-113.8kJ/mol
NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH3
SO3(g)+NO(g)ΔH3
则ΔH3=________,如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=________(用K1、K2表示)。
(2)如下图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2 mol NO和1 mol O2通过K1、K3分别充入A、B中,发生的反应为2NO(g)+O2(g)![]() 2NO2(g)[不考虑2NO2(g)
2NO2(g)[不考虑2NO2(g)![]() N2O4(g)],起始时A、B的体积相同均为a L。
N2O4(g)],起始时A、B的体积相同均为a L。

①下列说法和示意图能说明A、B容器均达到平衡状态的是________。
a.A、B容器中气体的颜色均不发生变化
b.A、B容器中NO和O2物质的量浓度比均为2∶1
c.A、B容器中气体的密度不在发生变化
d.A、B容器中气体的平均摩尔质量不再发生变化
e.
②T ℃时,A容器中反应达到平衡时的平衡常数Kp=0.27(kPa)-1。若A容器中反应达到平衡时p(NO2)=200 kPa,则平衡时NO的转化率为________。(Kp是用平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2和0.15 mol O2通入2 L的密闭容器中,测得SO2的物质的量随时间变化如下图实线所示。

①ab段平均反应速率______________(填“大于”“小于”或“等于”)bc段平均反应速率;de段平均反应速率为________。
②仅改变某一个实验条件,测得SO2的物质的量随时间变化如上图中虚线所示,则改变的条件是________。
③如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。阴极的电极反应式是_______________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com