
【题目】如下反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率而加入MnO2
D.降温加快H2O2的分解速率
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,广泛用于玻璃、医药、冶金、皮革等工业。回答下列问题:
(1) H3BO3中B元素的化合价为______,其在元素周期表的位置是_________________。
(2)已知:A(OH)3+H2O![]() [Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
[Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
(3) H3BO3受热分解得到的B2O3和镁粉混合点燃可得单质B,生成单质B的化学方程式为________。
(4) H3BO3可用于生产储氢材料NaBH4。涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O
II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①“反应I”的类型为__________(填标号)。
A.取代反应 B.加成反应 C.加聚反应 D.氧化反应
②NaH的电子式为_______________。
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁在空气中易被氧化,与硫酸铵反应生成硫酸亚铁铵[化学式为FeSO4·(NH4)2SO4·6H2O]后就不易被氧化。模拟工业制备硫酸亚铁铵晶体的实验装置如下图所示。请回答下列问题:

(1)仪器a的名称是______________________。
(2)铁屑中常含有Fe2O3、FeS等杂质,则装置C的作用是___________,装置B中发生反应的离子方程式可能是___________(填序号)。
A .Fe+2H+=Fe2++H2↑
B. Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++S2-=2Fe2++S↓
D.2Fe3++Fe=2Fe2+
(3)按上图连接好装置,经检验气密性良好后加入相应的药品,打开K1、K2,关闭K3,装置B中有气体产生,该气体的作用是___________。反应一段时间后,打开K3,关闭K1和K2。装置B中的溶液会流入装置A,其原因是______________________。
(4)按上图所示装置制备硫酸亚铁铵晶体的安全隐患是______________________。
(5)根据相关物质的溶解度判断,从装置A中分离出硫酸亚铁铵晶体,需采用的操作有___________、___________、洗涤、干燥。
三种盐的溶解度(单位为g/100gH2O)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )

①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④B. ②③C. ②④D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙苯制备苯乙烯的反应为:![]()
化学键 | C﹣H | C﹣C | C=C | H﹣H |
键能/KJ/mol | 412 | 348 | 612 | 436 |
下列说法错误的是
A. 上述反应的△H=+124kJmol﹣1 B. 乙苯比苯乙烯稳定
C. 乙苯中不存在碳碳双键 D. 1mol乙苯的能量与1mol苯乙烯能量相差264kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以天然气为原料合成甲醇。有关热化学方程式如下:
①2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH1=-70.8 kJ·mol-1
②CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
③2CH4(g)+O2(g)![]() 2CH3OH(g) ΔH3=-251.0 kJ·mol-1
2CH3OH(g) ΔH3=-251.0 kJ·mol-1
(1)ΔH2=________kJ·mol-1。
(2)在恒容密闭容器里,按物质的量比1:1加入一定量的碳和水蒸气反应生成水煤气。一定条件下达到平衡,当改变反应的某一条件时,下列变化能说明平衡一定向正反应方向移动的是_________。(填序号)
A.正反应速率先增大后减少 B.化学平衡常数K减少
C.再加入一定量碳 D.反应物气体体积分数增大
(3)在体积可变的密闭容器中投入1molCO和2mol H2,在不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。
CH3OH(g)。实验测得CH3OH的物质的量随温度、压强的变化如下图所示。

①该反应自发进行的条件是________(填“低温”、“高温”或“任意温度”)
②506K时,反应平衡时H2的转化率为________;压强:p1________(填“>”“<”或“=”)p2。
③反应速率:N点v正(CO)________(填“>”“<”或“=”)M点v逆(CO)。
(4)已知常温下,H2A在水中存在以下平衡:H2A![]() H++HA﹣,HA﹣
H++HA﹣,HA﹣![]() H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0。
H++A2﹣,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2﹣(aq)△H>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。
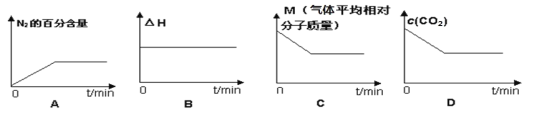
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是
![]()
物质 选项 | 甲 | 乙 | 丙 |
A | CuO | CO2 | H2O |
B | C | CO | CO2 |
C | CaCO3 | CaO | Ca(OH)2 |
D | H2SO4 | H2O | H2 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com