
【题目】下表所列各组物质中,物质之间按箭头方向不能通过一步反应实现如图所示转化的是
![]()
物质 选项 | 甲 | 乙 | 丙 |
A | CuO | CO2 | H2O |
B | C | CO | CO2 |
C | CaCO3 | CaO | Ca(OH)2 |
D | H2SO4 | H2O | H2 |
A.AB.BC.CD.D
【答案】C
【解析】
根据题目给出的流程图和信息:甲通过反应可以生成乙,甲通过反应生成乙,而甲乙则能通过反应都能生成丙,据此依据选项中物质的性质以及变化规律分析解答即可。
A、由于二氧化碳和碱液反应可以生成水,氧化铜和氢气反应也可以生成水,故能完成甲乙反应都能生成丙,而氧化铜则可以和一氧化碳反应生成二氧化碳,故能完成甲到乙的转化;
B、碳完全燃烧生成二氧化碳,一氧化碳燃烧生成二氧化碳,故能完成甲乙反应都能生成丙,而碳不完全燃烧生成一氧化碳,故能完成甲到乙的转化;
C、氧化钙与水反应生成氢氧化钙,故能够完成乙到丙的转化,碳酸钙受热分解生成氧化钙能完全甲到乙的转化,但是无法完成由碳酸钙转化为氢氧化钙即甲到丙的转化均不能完成;
D、水通电分解能生成氢气,稀硫酸与锌反应生成氢气,故能完成甲乙反应都能生成丙,而稀硫酸与氢氧化钠反应能生成硫酸钠和水,故能完成甲到乙的转化;
答案选C。


科目:高中化学 来源: 题型:
【题目】如下反应条件的控制中,不恰当的是( )
A.为防止铁生锈,在其表面涂一层防锈油漆
B.为防止火灾,在面粉厂、加油站等场所要严禁烟火
C.为加快KClO3的分解速率而加入MnO2
D.降温加快H2O2的分解速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.02mol/L的NaOH溶液,分别滴定浓度为0.0lmol/L的三种稀酸溶液,滴定的曲线如右图所示,下列判断正确的是

A. 三种酸均为弱酸,且同浓度的稀酸中导电性:HA<HB<HD
B. 滴定至P点时,溶液中:c(HB)>c(B-)
C. 溶液呈中性时,三种溶液中:c(A-)>c(B-)>c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙(黄绿色气体)、丙及物质C 、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
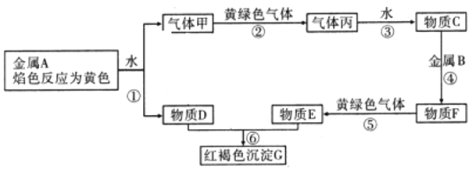
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A_______、B_______、G ________
(2)写出反应①的化学方程式__________________________________;反应⑤的离子方程式 ____________________________________;
(3)检验物质E的阳离子可以滴加KSCN,现象为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是一种试验某气体化学性质的实验装置。在A处通入氯气,图中B为开关,关闭B时,C中红色布条颜色无变化;打开B时,C处红色布条颜色褪去。由此做出的判断正确的是

A. D中可以是水 B. D中可以是饱和食盐水
C. D中不可能是浓H2SO4 D. 通入的氯气中含有水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于Fe(OH)3胶体的叙述中,正确的是( )
A. 制备Fe(OH)3胶体的化学方程式是FeCl3+3H2O![]() Fe(OH)3↓+3HCl
Fe(OH)3↓+3HCl
B. 在制备Fe(OH)3胶体的实验中,加热煮沸时间越长,越有利于胶体的生成
C. Fe(OH)3胶体微粒能吸附阳离子,从而使Fe(OH)3胶体带有一定电荷
D. Fe(OH)3胶体能够吸附水中悬浮的固体颗粒并沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下下列各组离子在指定溶液中能大量共存的是 ( )
A. c(H+)/c(OH-)=1×1012的溶液中:NH、Cl-、NO、Al3+
B. 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO、K+
C. pH=1的溶液中:Fe2+、NO、SO![]() 、Na+
、Na+
D. c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO![]() 、SCN-
、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学反应原理研究N、S氧化物有着重要的意义。
(1)已知:
2SO2(g)+O2(g) ![]() 2SO3(g)ΔH1=-196.6kJ/mol
2SO3(g)ΔH1=-196.6kJ/mol
2NO(g)+O2(g) ![]() 2NO2(g)ΔH2=-113.8kJ/mol
2NO2(g)ΔH2=-113.8kJ/mol
NO2(g)+SO2(g)![]() SO3(g)+NO(g)ΔH3
SO3(g)+NO(g)ΔH3
则ΔH3=________,如果上述三个反应方程式的平衡常数分别为K1、K2、K3,则K3=________(用K1、K2表示)。
(2)如下图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将2 mol NO和1 mol O2通过K1、K3分别充入A、B中,发生的反应为2NO(g)+O2(g)![]() 2NO2(g)[不考虑2NO2(g)
2NO2(g)[不考虑2NO2(g)![]() N2O4(g)],起始时A、B的体积相同均为a L。
N2O4(g)],起始时A、B的体积相同均为a L。

①下列说法和示意图能说明A、B容器均达到平衡状态的是________。
a.A、B容器中气体的颜色均不发生变化
b.A、B容器中NO和O2物质的量浓度比均为2∶1
c.A、B容器中气体的密度不在发生变化
d.A、B容器中气体的平均摩尔质量不再发生变化
e.
②T ℃时,A容器中反应达到平衡时的平衡常数Kp=0.27(kPa)-1。若A容器中反应达到平衡时p(NO2)=200 kPa,则平衡时NO的转化率为________。(Kp是用平衡分压代替平衡浓度计算所得的平衡常数,分压=总压×物质的量分数)
(3)将0.2 mol SO2和0.15 mol O2通入2 L的密闭容器中,测得SO2的物质的量随时间变化如下图实线所示。

①ab段平均反应速率______________(填“大于”“小于”或“等于”)bc段平均反应速率;de段平均反应速率为________。
②仅改变某一个实验条件,测得SO2的物质的量随时间变化如上图中虚线所示,则改变的条件是________。
③如图电解装置可将雾霾中的NO、SO2分别转化为NH4+和SO42-。阴极的电极反应式是_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5O-+CO32-
B. 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-![]() NH4++2Ag↓+3NH3+3H2O+HCOO-
NH4++2Ag↓+3NH3+3H2O+HCOO-
C. 乙醛与碱性氢氧化铜悬浊液混合后加热至沸腾:CH3CHO+2Cu(OH)2++2OH-![]() Cu2O↓+3H2O+CH3COO-
Cu2O↓+3H2O+CH3COO-
D. 向小苏打溶液中加入醋酸:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com