
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
| 0 | 2.0 | 2.0 | 0 |
| 2 | 0.8 | ||
| 4 | 1.2 | ||
| 6 | 1.2 | 2.8 |
| A. | 0~2 min内的平均速率为υ(CO)=0.6mol/(L•min) | |
| B. | 4min后,平衡移动的原因可能是向容器中加入了2.0mol的SO2 | |
| C. | 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应 | |
| D. | 其他条件不变,若起始时容器中MgSO4、CO均为1.0mol,则平衡时n(SO2)=0.6mol |
分析 A.由表中时间可知,0~2min内CO的物质的量变化量为2mol-0.8mol=1.2mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算v(CO)并判断;
B.由表中数据结合方程式可知,0~2min内CO、CO2、SO2的物质的量变化量为2mol-0.8mol=1.2mol,4~6min时,变化了0.4mol,据此分析;
C.计算该温度时反应平衡常数,根据升高温度平衡常数的变化判断平衡移动方向,据此解答;
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,等效为原平衡体积增大一倍,降低压强,平衡向正方向移动,据此分析解答.
解答 解:A.由表中时间可知,0~2min内CO的物质的量变化量为2mol-0.8mol=1.2mol,则v(CO)=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3 mol•L-1•min-1,故A错误;
B.由表中数据结合方程式可知,0~2min内CO、CO2、SO2的物质的量变化量为2mol-0.8mol=1.2mol,4~6min时,变化了0.4mol,所以平衡移动的原因可能是向容器中加入了2.0 mol的SO2,故B正确;
C.由表中时间可知,MgSO4(s)+CO(g)$\frac{\underline{\;点燃\;}}{\;}$MgO(s)+CO2(g)+SO2(g)
开始(mol):2 0 0
变化(mol):1.2 1.2 1.2
平衡(mol):0.8 1.2 1.2
故该温度下平衡常数k=$\frac{\frac{1.2}{2}×\frac{1.2}{2}}{\frac{0.8}{2}}$=0.9,若升高温度,反应的平衡常数变为l.00,则平衡向正反应方向移动,所以正反应为吸热反应,故C错误;
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,等效为原平衡体积增大一倍,降低压强,平衡向正方向移动,故到达平衡时n(CO2)>0.60mol,故D错误;
故选B.
点评 本题考查反应速率计算、影响化学平衡因素、化学平衡常数等,难度中等,注意基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | ⑤>④>①>③>② | B. | ⑤>④>③>①>② | C. | ⑤>④>①>②>③ | D. | ④>⑤>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加热,Kw增大,pH不变 | |
| B. | 燃烧热是指可燃物热化学反应方程式中的△H | |
| C. | 用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 | |
| D. | 醋酸溶液的导电能力可能比稀硫酸强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 镀锌的铁比镀锡的铁耐用 | |
| C. | 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快 | |
| D. | 银制奖牌久置后表面变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体是带电的 | |
| B. | 通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 | |
| C. | 依据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| D. | 一束光线分别通过溶液和胶体时,后者会出现明显的光带,前者则没有 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
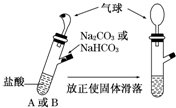
| A. | A装置的气球膨胀速度快 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na+的物质的量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
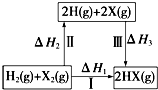
| A. | H2(g)+X2(g)═2H(g)+2X(g)△H2<0 | |
| B. | △H1=△H2+△H3 | |
| C. | 途径Ⅲ的按Cl、Br、I顺序依次增大 | |
| D. | 途径Ⅰ生成HCl比生成HBr的△H1小,说明HCl比HBr稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 37gNH4F和16gCH4中含有的共价键数均为4NA | |
| B. | 0.51.4mol•L-1的NaHSO3溶液中含有的SO32-数为2NA | |
| C. | 标准状况下,16.8LNO2完全溶于水,转移电子数为0.5NA | |
| D. | 高温高压和催化剂条件下,密闭容器中2gH2与足量N2反应,转移电子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com