
【题目】已知Ksp(AgCl) = 1.56 × 10-10, Ksp(AgBr) = 7.7 × 10-13,Ksp(Ag2CrO4) = 9.0× 10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010molL-1,向该溶液中逐滴加入0.010molL-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42-
B.CrO42-、Br-、Cl-
C.Br-、Cl-、CrO42-
D.Br-、CrO42-、Cl-
科目:高中化学 来源: 题型:
【题目】写出下列反应的热化学方程式:
(1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1 366.8 kJ热量: 。
(2)1 mol C(石墨)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ热量: 。
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量: 。
⑷已知下列反应的反应热为
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
③H2(g)+![]() O2(g)=H2O(l) △H3=-285.8kJ/mol
O2(g)=H2O(l) △H3=-285.8kJ/mol
试计算下述反应的反应热:2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了A﹣R 9种元素在周期表中的位置

(1)这 9种元素中化学性质最不活泼的是________(以上均填元素符号)
(2)B、C、D三种元素按原子半径由大到小的顺序排列为________(用元素符号表示)
(3)F元素简单氢化物的化学式是________,H元素跟B元素形成化合物的化学式是______,高温灼烧该化合物时,火焰呈________色.
(4)G元素和 H元素两者核电荷数之差是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PC 是一种可降解的聚碳酸酯类高分子材料,具有广泛应用,其结构简式为:
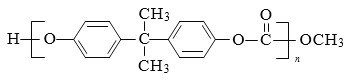 。一种生产 PC 的合成路线如下:
。一种生产 PC 的合成路线如下:
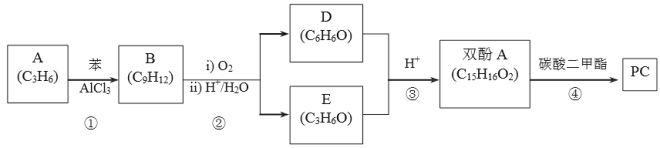
其中,A 可使 Br2 的 CCl4 溶液褪色,B 中有五种不同化学环境的氢,D 可与 FeCl3 溶液发生显色反应;E 可与 H2 发生加成反应,其核磁共振氢谱为单峰。
已知: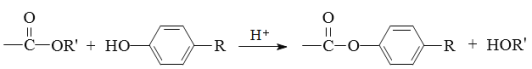
请回答下列问题:
(1)D 中官能能团名称 ,A 的结构简式是 ,A 与 Cl2 反应的产物名称是 ,B 的结构简式是 。
(2)第③步反应的化学方程式是 。
(3)碳酸二甲酯的一种同分异构体名叫乳酸,该物质能发生的化学反应有 (填字母)。
a. 取代反应 b. 加成反应 c. 消去反应 d. 加聚反应
(4)碳酸二甲酯有多种同分异构体,写出其中能与 Na2CO3 溶液反应的任意一种同分异构体结构简式 (乳酸除外)
(5)第④步反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10.0mL0.10mol·L-1氨水中滴入10 mL0.1 mol·L-1盐酸,溶液的PH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是

A.M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.M点对应的盐酸体积为10.0mL
C.PH=7溶液中存在c(Cl-)=c(NH4+)=c(OH-)=c(H+)
D.p点处的溶液中存在:2c(NH4+)+2c(NH3H2O)=c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化,吸附,絮凝于一体的新型多功能水处理剂,高铁酸盐热 稳定性差。制备方法有湿法、干法两种,其原理如下表所示:
湿法的生产工艺如下:
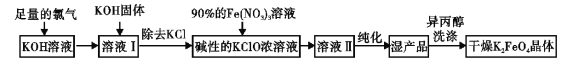
回答下列问题:
(1)K2FeO4 中Fe的化合价 ;实验室干法制备中选用的仪器是
A.蒸发皿 B.铁坩埚 C.氧化铝坩埚 D.陶瓷坩埚
(2)在温度较高时KOH与Cl2反应生成的是KClO3,写出在温度较高时KOH与Cl2反应的化学方程式
___________________;
(3)在溶液 I 中加入KOH 固体的目的是
A.使 KClO3 转化为 KClO
B.为下一步反应提供碱性的环境
C.KOH 固体溶解放热,有利于提高反应速率
D.与溶液 I 中过量的 Cl2 继续反应,生成更多的 KClO
(4)向次氯酸钾强碱浓溶液中加入 90%的 Fe(NO3)3,发生反应的离子方程式为:
① Fe3++3OH-═Fe(OH)3;② 。
(5)用异丙醇代替蒸馏水洗涤湿产品,除能洗去杂质外,其优点有 。
(6)如何判断 K2FeO4 晶体已经洗涤干净 。
(7)高铁酸钾(K2FeO4)作为水处理剂的优点之一是能除去悬浮杂质,配平该反应的离子方程式:
____FeO42-+ H2O= Fe(OH)3(胶体)+ O2↑+ ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吸毒严重危害身心健康,对肝、肾、脑的损害尤其大,同时易传染疾病,使人变得不负责任,不顾廉耻,一人吸毒祸及全家。下列不属于毒品的是( )
A.麻古(冰毒片剂) B.K粉(氯胺酮)
C.大麻(四氢大麻酚) D.抗酸药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(MnO2)、黄铁矿(FeS2)酸浸生产硫酸锰(MnSO4),并进一步电解制取二氧化锰(EMD)的工艺流程如下:
I. 将软锰矿、黄铁矿和硫酸按一定比例放入反应釜中,搅拌,加热保温反应一定时间。
II. 向反应釜中加入MnO2、CaCO3试剂,再加入Na2S溶液除掉浸出液中的重金属。
III. 过滤,向滤液中加入净化剂进一步净化,再过滤,得到精制MnSO4溶液。
IV. 将精制MnSO4溶液送入电解槽,电解制得EMD。
请回答下列问题:
(1)步骤I中搅拌、加热的目的是 。完成酸浸过程中反应的离子方程式:
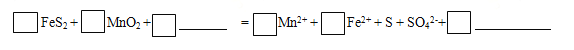
(2) 加入CaCO3将浸出液pH调至pH=5,从而除掉铁,请解释用CaCO3除铁的原理: 。(结合离子方程式解释)
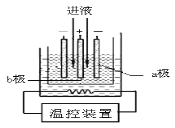
(3)步骤IV中用如图所示的电解装置电解精制的MnSO4溶液,生成EMD的是
极(填“a”或“b”),生成EMD的电极反应式是 。
(4)EMD可用作碱性锌锰电池的材料。已知碱性锌锰电池的反应式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。
下列关于碱性锌锰电池的说法正确的是 (填字母序号)。[来源
A.碱性锌锰电池是二次电池
B.碱性锌锰电池将化学能转化为电能
C.正极反应为:2MnO2+2H2O+2e-=2MnOOH+2OH-
D.碱性锌锰电池工作时,电子由MnO2经外电路流向Zn极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com