
【题目】下列转化不能通过一步反应实现的是( )
A.H2S+O2→SO2
B.SO2+H2O→H2SO3
C.S+O2→SO3
D.SO3+H2O→H2SO4
科目:高中化学 来源: 题型:
【题目】常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是
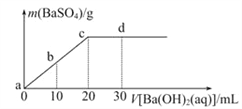
A. a~d溶液的pH:a<b<c<d
B. a~d溶液的导电能力:a<b<c<d
C. b处溶液的c(H+)与d处溶液的c (OH-)相等
D. c处溶液和d处溶液均呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,按要求作答: 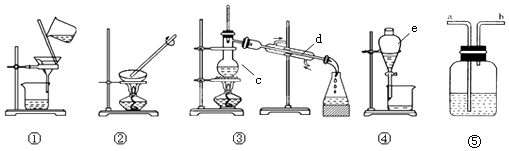
(1)装置中c、d、e的名称分别为、、
(2)分离下列物质,需要在哪套装置中进行 Ⅰ.干燥H2 , 可采用(填装置序号)装置
Ⅱ.除去食盐溶液中的水,可采用(填装置序号)装置
Ⅲ.淡化食盐水,可采用(填装置序号)装置
Ⅳ.实验室中的石灰水久置,液面上常悬浮有CaCO3微粒.可采用(填装置序号)装置除去Ca(OH)2溶液中悬浮的CaCO3微粒
Ⅴ.分离碘水中的碘应先选择装置(填装置序号) 进行和操作,再用装置(填装置序号)进行操作.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池利用不同价态离子对的氧化还原反应来实现化学能和电能的相互转化,充电时,惰性电极M、N分别连接电源的正极和负极。电池工作原理如图所示,下列说法不正确的是 ( )

A. 充电过程中,N电极附近酸性减弱
B. 充电过程中,N电极上V3+被还原为V2+
C. 放电过程中,H+由N电极向M电极移动
D. 放电过程中,M电极反应为VO2++ 2H++e-= VO2+ +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为0.5L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色)N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示. 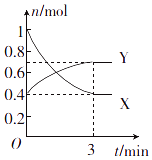
(1)曲线(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线.
(2)在0~3min内,用NO2表示的反应速率为 .
(3)下列叙述能说明该反应已达到化学平衡状态的是(填字母). a.容器内压强不再发生变化
b.NO2的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolN2O4的同时生成2nmol NO2
(4)反应达到平衡后,若降低温度,则v(正) , v(逆) . (填“增大”“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3和杂质)为原料制备铝的一种工艺流程如下:

注:反应Ⅰ“碱溶”时杂质转化为沉淀
(1)反应Ⅰ,发生反应生成偏铝酸钠的离子方程式__________。
(2)电解Ⅰ是电解熔融的冰晶石和Al2O3的混合物,电解过程中作阳极的石墨易消耗,原因是___________。
(3)反应Ⅱ,用一定浓度的NaHCO3溶液处理过滤Ⅰ后的滤液,所得溶液pH和生成Al(OH)3的量随加入NaHCO3溶液体积变化的曲线如下:

①加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式__________。
②反应Ⅱ中生成Al(OH)3的离子方程式__________。
(4)电解Ⅱ是电解Na2CO3溶液,得到含NaHCO3的阳极液,原理如下图所示。

阴极产生的物质A的化学式为____________。
(5)以铝材为阳极,在H2SO4溶液中电解,可在铝材表面形成致密氧化膜,阳极电极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种工业盐,实验室可用如下装置(略去部分夹持仪器)制备。

已知:①2NO+Na2O2=2NaNO2; ②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;③酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______________。
(2)装置A中发生反应的化学方程式为__________________________________。实验结束后,将B瓶中的溶液经蒸发浓缩、__________(填操作名称)、过滤可获得CuSO4·5H2O。
(3)仪器C的名称为______________,其中盛放的药品为 ____________(填名称)。
(4)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,________________,则产物是NaNO2(注明试剂、现象)。
(5)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:

①第一组实验数据出现异常,造成这种异常的原因可能是_________(填代号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时仰视读数
②根据表中数据,计算所得固体中亚硝酸钠的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在原电池中,通常较活泼的金属做_____极,发生_______反应;
电解池中,与电源正极相连的极是_______极,发生________反应。
(2)下图所示水槽中试管内有一枚铁钉,放置数天后观察:

①若试管内液面上升,发生_____腐蚀,正极反应式为________________。
②若试管内液面下降,发生_______腐蚀,正极反应式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类对某金属冶炼技术的掌握程度决定了其应用的广泛性。影响冶炼方法的主要因素是
A.金属的活动性大小 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的导电性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com