
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。

下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
【答案】D
【解析】m、n两种单质可字放电条件下进行,一般为氮气和氧气的反应,则r为NO,且可继续与n反应,则m为N2,n为O2,可知Y为N元素,Z为O元素,s为NO2,q为H2O,t为HNO3,单质p与水反应生成u具有漂白性,则p为Cl2,u为HClO,v为HCl,则W为Cl元素,由原子序数关系可知X为H元素;A.物质u为HClO是共价化合物,只含共价键,不含离子键,故A错误;B.常温常压下,NO2为红棕色气体,故B错误;C.原子序数N<O,水的稳定性比氨气强,故C错误;D.H、N、O三种元素形成的化合物如为硝酸或硝酸铵,水溶液显酸性,如形成NH3·H2O,其水溶液显碱性,故D正确;答案为D。


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
①在热化学方程式中无论是反应物还是生成物都必须标明状态 ②所有的化学反应都伴随着能量变化 ③放热反应发生时不必加热 ④吸热反应在加热后才能发生 ⑤化学反应的热效应数值只与参加反应的物质的多少有关 ⑥一般来说,吸热反应在一定条件下也能发生 ⑦依据盖斯定律,反应焓变的大小与反应的途径有关
A.②③⑥⑦ B.③④⑤⑦ C.④⑤⑦ D.③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是( )
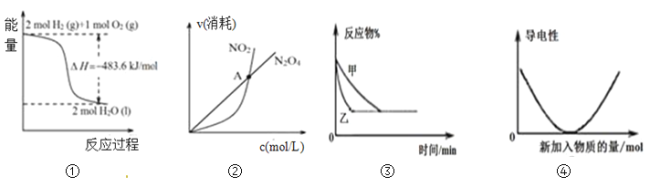
A.图①可知:热化学方程式是H2(g)+1/2O2(g)=H2O(g)△H=﹣241.8kJ/mol
B.图②可知:对于恒温恒容条件下的反应2NO2(g)![]() N2O4(g),A点为平衡状态
N2O4(g),A点为平衡状态
C.图③可表示:压强对2A(g)+2B(g)![]() 3C(g)+D(s)的影响
3C(g)+D(s)的影响
D.图④可表示:Ba(OH)2溶液中滴加稀硫酸,溶液导电性的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中表示碳原子相互结合的几种方式。小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢原子结合,则下列说法正确的是
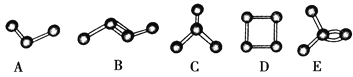
A. 图中属于烷烃的是A、C、D
B. 图中C和E分子中氢原子数相同
C. 图中物质碳元素的质量分数最小的是A
D. 图中与B互为同分异构体的有C、D、E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.6 kJ·mol-1。
2NH3(g) ΔH=-92.6 kJ·mol-1。
实验测得起始、平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡时体系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数相等
C.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
D.容器②中达平衡时放出的热量Q=23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g) ![]() 2Z(g) 、②2M(g)
2Z(g) 、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
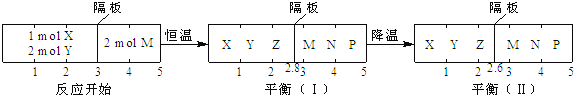
下列判断正确的是
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时,X的转化率为![]()
D.在平衡(I)和平衡(II)中M的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有机物同分异构体数目判断中不正确的是
A. 立方烷( )的六氨基(-NH2)取代物有3种。
)的六氨基(-NH2)取代物有3种。
B. C3H7ClO(有羟基)的同分异构体数目有5种
C. 甲苯与氢气充分加成后的—溴代物有4种。
D. 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH不稳定、易分解、在氯气中能燃烧,与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是2Cu+= Cu2++Cu。根据以上信息回答:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是____________。
(2)写出CuH在氯气中燃烧的化学反应方程式_________________。
(3)CuH溶解在稀盐酸中生成的气体是______________,如果反应中生成了标准状况下22.4 L的气体,被还原的离子得电子的物质的量是__________。
II:用高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物。
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,则化学反应方程式为__________________________。
(2) 有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示。则ClO2的有效氯含量是___________。
(3)某同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他进行了如下实验:向30.00 mL水样中加几滴K2CrO4溶液作指示剂,用0.001 mol·L-1 AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12 mL。
①水样中Cl-的物质的量浓度是__________。
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。如在滴定终点时,测得溶液中CrO42-的浓度是5.0×10-3mol·L-1。试计算此时溶液中Cl-的浓度是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中不正确的是
A.锌、铜电极和稀硫酸溶液构成的原电池中铜是正极
B.在镀件上镀铜时可用金属铜作阳极
C.用电解法精炼粗铜时粗铜发生氧化反应
D.用电解法精炼粗铜时纯铜作阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com