
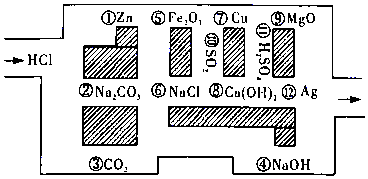
分析 (1)中和反应是酸与碱反应,根据碱的种类确定中和反应的个数;根据化合价变化判断氧化还原反应;能与盐酸反应的盐只有碳酸钠;碳酸钠和盐酸都属于强电解质,反应生成二氧化碳气体和水,水、二氧化碳在离子反应中保留化学式;
(2)电解质:在水溶液中或熔融状态下能够导电的化合物;非电解质:在熔融状态和水溶液中都不能导电的化合物;
(3)解决该题应该找出一条不能和盐酸发生反应的物质构成的路.酸的化学性质有:能够和酸碱指示剂变色,能够和活泼金属反应,能够和金属氧化物反应,能够和碱反应,能够和某些盐反应.活泼金属即在金属活动性顺序表中氢前的金属,酸和金属氧化物、碱、盐发生的反应是复分解反应,因此必须有水、沉淀或气体生成.
解答 解:(1)中和反应是酸与碱反应,根据碱的种类确定中和反应的个数,碱有2种,则中和反应有2个;能与盐酸反应化合价发生变化的只有锌,则发生的氧化还原反应只有1个;能与盐酸反应的盐只有Na2CO3,碳酸钠和盐酸都属于强电解质,在溶液中完全电离,反应生成二氧化碳气体和水,反应的化学方程式为Na2CO3+2HCl═2NaCl+CO2↑+H2O,反应的离子方程式为CO32-+2H+=CO2↑+H2O,
故答案为:2;1;Na2CO3;CO32-+2H+=CO2↑+H2O;
(2)与盐酸不反应的有二氧化碳、不活泼金属铜和银、氯化钠、二氧化硫、硫酸,
二氧化碳和二氧化硫自身不能电离,属于非电解质;
铜和银是金属单质,既不是电解质也不是非电解质;
氯化钠在水溶液中或熔融状态下能够导电,属于电解质;
硫酸在水溶液中能够导电,属于电解质;
故属于电解质的是:⑥氯化钠,⑪硫酸;属于非电解质的是:③二氧化碳,⑩二氧化硫,
故答案为:⑥⑪;③⑩;
(3)利用图示的物质对相关的与盐酸不能反应的物质作出判断即可,由于盐酸不能和二氧化碳、二氧化硫、硫酸、铜、银等反应,走出迷宫所走的路线为③→⑥→⑩→⑦→⑪→⑫,
故答案为:③→⑥→⑩→⑦→⑪→⑫.
点评 本题考查物质的性质,为高频考点,综合考查元素化合物知识,把握金属及化合物的性质、反应类型及发生的反应为解答的关键,侧重分析能力及知识的应用能力和解决问题的能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA | |
| B. | 通常状况下,8g O2和O3的混合气体含有的分子数是0.5NA | |
| C. | 常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl- 个数为0.4NA | |
| D. | 标准状况下,11.2L He分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )
一定温度下,在冰醋酸加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点pH不同 | |
| B. | 向c溶液中加水,溶液中所有离子浓度都减小 | |
| C. | 误用湿润的pH试纸测b点pH结果偏大 | |
| D. | $\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$b点大于c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10ml | 20.30ml |
| 第二次 | 0.30ml | 20.10ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若丙醇中的氧为188O,它与乙酸反应生成的酯的相对分子质量是104 | |
| B. | 用乙酰水杨酸 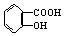 与适量NaOH溶液反应制备 与适量NaOH溶液反应制备 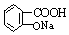 | |
| C. | 向柠檬醛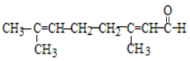 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 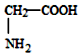 、 、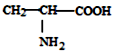 、 、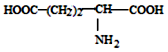 三种氨基酸脱水,最多可生成 6种二肽 三种氨基酸脱水,最多可生成 6种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(c)=0.2mol/(L•s) | B. | z=3 | ||
| C. | B的转化率为75% | D. | 反应前与2s后容器的压强比为4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 在反应中不一定所有元素的化合价都发生变化 | |
| C. | 金属单质在反应中只作还原剂,非金属单质在反应中只作氧化剂 | |
| D. | 金属原子失电子越多,其还原性越强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com