
【题目】已知 Ca(OH)2 与 Cl2 反应的氧化产物与温度有关,在一定量的石灰乳中通入足量的氯气,二者恰好完全反应。生成 Cl-、ClO-、ClO3- 三种含氯元素的离子,其中 ClO- 、ClO3- 两种离子的物质的量(n)与反应时间
(t)的曲线如图所示。

(1)t1 时,开始有 ClO3-生成的原因是_____。
(2)t2 时,Ca(OH)2 与 Cl2 发生反应的总的化学方程式为___________。
(3)该石灰乳中含有 Ca(OH)2 的物质的量是________mol。
(4)若反应物的量不变,在某温度下恰好完全反应时,氧化产物比值为![]() a ,则 n(Cl-)=_____mol
a ,则 n(Cl-)=_____mol
(用含 a 的代数式来表示)。
【答案】反应放热使温度升高,在较高温度下可生成 ClO3-10Cl2+10Ca(OH)2=Ca(ClO3)2+2Ca(ClO)2+7CaCl2+10H2O5![]()
【解析】
(1)由已知条件可知,氢氧化钙和氯气反应的氧化产物与温度有关,放热反应使温度升高,在较高温度下可生成ClO3-;
(2)由图可知,t2时n(ClO-)=2mol,n(ClO3-)=1mol,所以氯气与氢氧化钙反应生成CaCl2、Ca(ClO)2、Ca(ClO3)2、H2O,且n[Ca(ClO)2]:n[Ca(ClO3)2]=2:1,配平书写方程式;
(3)由图可知,t2时氢氧化钙与氯气恰好反应,n(C1O-)=2mol,故n[Ca(ClO)2]=1mol,n(ClO3-)=1mol,故n[Ca(ClO3)2]=0.5mol,根据方程式计算;
(4)参加反应的氯气n(Cl2)=n[Ca(OH)2]=5mol,根据氯元素守恒可知,n(ClO-)+ n(ClO3-) +n(Cl-)=2n(Cl2)=10mol,若n(ClO-)/n(ClO3-)=a,则an(ClO3-)+ n(ClO3-)=10-n(Cl-),根据电子转移守恒有,a n(ClO3-)+5 n(ClO3-) =n(Cl-),联立方程计算n(Cl-)。
(1)由图可知,t1前发生Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O,该反应为放热反应,温度升高,t1时开始反应生成Ca(ClO3)2;正确答案:反应放热使温度升高,在较高温度下可生成 ClO3-。
(2)由图可知,t2时n(ClO-)=2mol,n(ClO3-)=1mol,所以n(ClO-)/n(ClO3-)=2;氯气与氢氧化钙反应生成CaCl2、Ca(ClO)2、Ca(ClO3)2、H2O,且n[Ca(ClO)2]:n[Ca(ClO3)2]=2:1,反应方程式为10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O;正确答案:10Cl2+10Ca(OH)2=Ca(ClO3)2+2Ca(ClO)2+7CaCl2+10H2O。
(3)由图可知,t2时氢氧化钙与氯气恰好反应,n(ClO-)=2mol,故n[Ca(ClO)2]=1mol, n(ClO3-)=1mol,故n[Ca(ClO3)2]=0.5mol,根据方程式10Cl2+10Ca(OH)2=7CaCl2+2Ca(ClO)2+Ca(ClO3)2+10H2O可知,n[Ca(OH)2]=10n[Ca(ClO3)2]=0.5mol×10=5mol;正确答案: 5。
(4)由(3)可知,参加反应的氯气n(Cl2)=n[Ca(OH)2]=5mol,根据氯元素守恒可知,n(ClO-)+ n(ClO3-)+n(Cl-)=2n(Cl2)=10mol,若n(ClO-)/n(ClO3-)=a,则a n(ClO3-)+ n(ClO3-)=10-n(Cl-),根据电子转移守恒有,a n(ClO3-)+5 n(ClO3-)=n(Cl-),联立方程解得, n(ClO3-)=5a+3,则n(Cl-)=(5a+25)/(a+3);正确答案:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在棕色试剂瓶中并放置在阴凉处
B.少量的金属钠保存在煤油中
C.液溴应保存在棕色细口瓶,并加水液封
D.新制的氯水通常保存在无色玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al2O3和SiO2的混合物经过下列流程处理,可以回收其中的铝元素。

试计算:
(1)若铝元素全部转化为铝单质,则Al2O3在原混合物中的质量分数为多少______?
(2)若盐酸恰好溶解其中的Al2O3,则盐酸的物质的量浓度为多少mol/L______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型镁储备电池的储存寿命长,电压平稳,电池的总反应为Mg+Cu2Cl2=2Cu+MgCl2,以该电池为电源在铜片上镀银的实验装置如图所示。
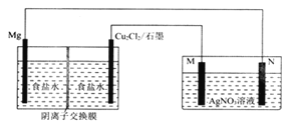
下列说法正确的是
A. 若反应消耗1mol Mg,则有1mol Cl-通过阴离子交换膜
B. M电极材料为铜片
C. 接通电路后,电池的正极质量减小
D. 接通电路后,AgNO3溶液的浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示为下图所示
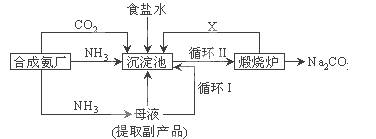
(1)侯氏制碱法又称___________,副产品的一种用途为____________ .
(2)写出上述流程中 X 物质的分子式________。
(3)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水中,再滴加_________。
(4)请简述与索尔维法相比,侯氏制碱法的优点:____。
(5)如图是在实验室中模拟“氨碱法”制取 NaHCO3 的部分装置。
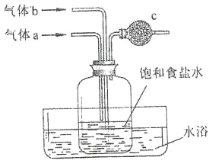
完成下列填空:
仔细观察两只通气导管内所处的位置,由此推断:
气体 a 为_____,气体 b 为_________;两者的通入次序为_____。 为防止尾气污染,c 中可放入蘸_____溶液的脱脂棉。
(6)气体 a 与 b 均可用如图装置进行制备。 当锥形瓶中固体为生石灰时,分液漏斗中应盛放_________。 用该装置制备另一种气体的方法是:_____(用离子方程式表示)。
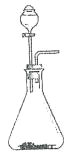
(7)反应过程中可以看到装置饱和食盐水中有晶体逐渐析出,写出相关反应的化学方程式:________。
(8)反应过程中采用水浴加热,其优势是_____。
水浴温度维持在 42℃左右,温度过低,反应速率太慢,不利于晶体析出;温度过高,_____,也不利于晶体析出。
(9)反应结束后,将热水浴换成冰水浴,冷却 15min 左右再进行过滤,目的是:_________。
(10)得到的 NaHCO3 晶体中会含有少量 NaCl 杂质,可采用如下方法进行纯度测定:
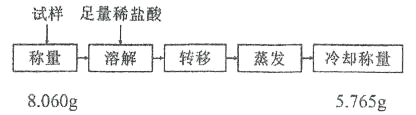
该试样中 NaHCO3 的质量分数为_____(精确到 0.01)。若称量操作无误,但最终测定结果的相对误差为 1.5%,写出可能导致该结果的一种情况:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属矿物质开发的叙述正确的是( )
A. 从金属矿物中获得金属是金属元素被氧化的过程
B. 从HgO中获得金属Hg可以直接用加热分解的方法
C. 从NaCl中获得金属Na可用还原剂还原
D. 从Fe2O3中获得金属Fe,工业上常用电解法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列气体:①N2、②O2、③NO2、④NO、⑤CO2、⑥CO,其中属于大气污染物的是( )
A.③④⑥B.①②③④C.③④⑤⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某农民偶然发现一头小母牛食用腐败草料后,血液不会凝固。化学家由此得到启发,从腐败草料中提取出结构简式为下图所示的双香豆素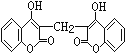 。下列关于双香豆素的推论中正确的是______
。下列关于双香豆素的推论中正确的是______
A.分子式为C19H12O6
B.能使FeCl3溶液发生显色反应
C.1mol 该物质最多可与10mol H2发生加成反应
D.它可由化合物  和甲醛(HCHO)在一定条件下反应制得
和甲醛(HCHO)在一定条件下反应制得
II.丁苯酞是我国自主研发的一类用于治疗急性缺血性脑卒的新药。合成丁苯酞(J)的一种路线如图所示:
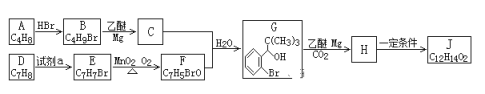
已知:①A的核磁共振氢谱有两组峰,
② 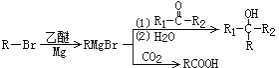
(1)A的名称是_________________;
(2)D生成E的反应类型为________________,试剂a是_____________;
(3)一定条件下,B可以发生化学反应生成A,则B生成A的化学方程式_______;
(4)H在一定条件下还能生成高分子化合物K,H生成K的化学方程式为________;
(5)M组成比F多1个CH2,M的分子式为C8H7BrO,M的同分异构体中,同时满足下列条件的同分异构体共有__________种。
①能发生银镜反应; ②含有苯环; ③不含甲基。
(6)利用题中信息写出以乙醛和苯为原料,合成![]() 的路线流程图______(其它试剂自选)。
的路线流程图______(其它试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于中和热测定实验的下列说法不正确的是
A. 烧杯间填满碎泡沫塑料是减少实验过程中的热量损失
B. 使用环形玻璃搅拌棒既可以搅拌又避免损坏温度计
C. 向盛装酸的烧杯中加碱时要小心缓慢
D. 测酸后的温度计要用水清洗后再测碱的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com