
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算HxR气体的物质的量,再结合M=$\frac{m}{n}$计算相对分子质量;
(2)5.1gHxR气体的物质的量为0.15mol,CuSO4的物质的量也是0.15mol,二者等物质的量反应,则发生反应:HxR+CuCl2═CuR↓+2HCl,结合原子守恒计算x的值,进而确定R元素.
解答 解:(1)标况下,HxR气体的物质的量=$\frac{5.6L}{22.4L/mol}$=0.25mol,则其摩尔质量=$\frac{8.5g}{0.25mol}$=34g/mol,摩尔质量在数值上等于其相对分子质量,所以其相对分子质量为34.
故答案为:34;
(2)n(HxR)=$\frac{5.1g}{34g/mol}$=0.15mol,而200mL 0.75mol•L-1的CuCl2溶液中氯化铜的物质的量为:0.2L×0.75mol•L-1=0.15mol,二者等物质的量反应,则HxR+CuCl2═CuR↓+2HCl,由氢元素和氯元素质量守恒可知x=2,则Ar(R)=34-2=32,故R原子的质量数为32,R的质子数和中子数均为16,R为硫元素,
答:x为2,R为硫元素.
点评 本题考查物质的量有关计算、化学方程式计算以及质子数与中子数、质量数之间的关系等知识点,难度不大,注意对基础知识的掌握.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol固体S单质燃烧放出的热量大于293.23 kJ | |
| B. | 1mol气体S单质燃烧放出的热量小于293.23 kJ | |
| C. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备催化剂的元素 | B. | 耐高温的合金元素 | ||
| C. | 用于半导体材料的元素 | D. | 制备农药的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯在银作催化剂的条件下与氧气反应生成环氧乙烷 | |
| B. | 乙烯水化法制乙醇 | |
| C. | 乙烯与氯化氢加成制氯乙烷 | |
| D. | 利用乙烯与氢气加成制得的乙烷与氯气在光照条件下制氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | NH4NO3 | NaOH | NaCl | KNO3 |
| 溶解热(kJ/kg) | -330.75 | +1040.5 | -84.10 | -353.17 |
| A. | NH4NO3 | B. | NaOH | C. | NaCl | D. | KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 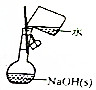 配制0.10mol•L-1的NaOH溶液 配制0.10mol•L-1的NaOH溶液 | |
| B. | 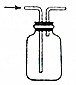 在实验室中用排空气法收集CO2 在实验室中用排空气法收集CO2 | |
| C. | 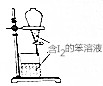 用苯萃取碘水中的碘,分出水层后的操作 用苯萃取碘水中的碘,分出水层后的操作 | |
| D. | 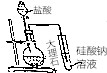 比较Cl,C,Si三种元素的非金属性强弱 比较Cl,C,Si三种元素的非金属性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com