
氰酸铵(NH4CNO)与尿素[CO(NH2)2]
A.都是共价化合物 B.都是离子化合物
C.互为同分异构体 D.互为同系物
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014江西省上饶市第二学期期末教学质量测试高二化学试卷(解析版) 题型:实验题
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2?A12O3?CaO?MgO等杂质)?用该烧渣制取药用辅料——红氧化铁的工艺流程如下:

(1)在“还原焙烧”中产生的有毒气体可能有 ?
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中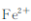 含量将下降,其原因是 (用离子方程式表示)?
含量将下降,其原因是 (用离子方程式表示)?
(3)根据下表数据:

在“除杂”步骤中,为除去 和
和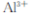 ,溶液的pH最大值应小于 ,常温下,当
,溶液的pH最大值应小于 ,常温下,当
pH=5 时,溶液中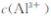 =
=  (已知常温下
(已知常温下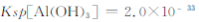 )?
)?
(4)“中和合成”的目的是将溶液中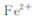 转变为碳酸亚铁沉淀,则A的操作是 ?
转变为碳酸亚铁沉淀,则A的操作是 ?
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高二下学期期终考试化学试卷(解析版) 题型:填空题
利用反应:Cu2Cl2 +C2H2+2NH3→Cu2C2(乙炔亚铜,红色)+2NH4Cl可检验乙炔。
(1)基态时亚铜离子核外电子排布式为 。
(2)NH3中氮原子的杂化方式为 ;NH4+空间构型为 (用文字描述)。
(3)乙炔分子中σ键与π键数目之比为 ,与C22-互为等电子体的分子有 (写化学式,举一例)。
(4)氯化亚铜晶胞结构如下图,晶胞中含Cu+数目为 。

(5)合成氨工业常用铜(I)氨溶液吸收CO生成[Cu(NH3)3(CO)]+,该配离子中配体有 (写化学式)。
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高二下学期期终考试化学试卷(解析版) 题型:选择题
在101kPa 25℃时,1.0g乙烷气体完全燃烧生成液态水时放出热量52.0kJ,则乙烷燃烧的热化学方程式为
A.C2H6(g) +  O2(g)=2CO2(g) +3H2O(l) △H =-1560kJ·mol-1
O2(g)=2CO2(g) +3H2O(l) △H =-1560kJ·mol-1
B.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(g) △H =-1560kJ·mol-1
C.2C2H6(g) + 7O2(g)=4CO2(g) +6H2O(l) △H =+3120 kJ·mol-1
D.C2H6(g) + O2(g)=2CO2(g) +3H2O(l) △H =-52.0kJ·mol-1
O2(g)=2CO2(g) +3H2O(l) △H =-52.0kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高一下学期期末考试化学试卷(解析版) 题型:选择题
在t℃时,10mL0.4mol·L-1H2O2溶液发生催化分【解析】
2H2O2 = 2H2O + O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表
t /min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~2min H2O2平均反应速率比4~6min快
B.0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol·L-1·min-1
C.反应至6min时,c(H2O2)=0.3mol·L-1
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列变化中,吸收的热量用于克服分子间作用力的是
A.加热金属铝使之熔化
B.加热金刚石使之熔化
C.液溴受热变成溴蒸气
D.加热碘化氢使之分解
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省盐城市高一下学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.食品保鲜膜成分为聚氯乙烯
B.甲醛可作为海产品的防腐剂
C.盐析可提纯蛋白质并保持其生理活性
D.医疗上用于消毒的酒精其体积分数为95%
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:选择题
用食用白醋(醋酸浓度约为1 mol/L)进行下列实验,能证明醋酸为弱电解质的是
A.白醋中滴入石蕊试液呈红色 B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出 D.pH试纸显示醋酸的pH为2~3
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省淮安市高三第三次调研测试化学试卷(解析版) 题型:实验题
(15分)三氯氧磷(化学式:POCl3)常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

⑴氯化水解法生产三氯氧磷的化学方程式为 。
⑵通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (选填字母),滴定终点的现象为 。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是 ,如无此操作所测Cl元素含量将会 (填“偏大”、“偏小”或“不变”)
⑶氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水。在废水中先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是 。
②下图是不同条件对磷的沉淀回收率的影响图像。

处理该厂废水最合适的工艺条件为 (选填字母)。
a.调节pH=9 b.调节pH=10 c.反应时间30 min d.反应时间120 min
③若处理后的废水中c(PO43-)=4×10-7 mol·L-1,溶液中c(Ca2+)= mol·L-1。
(已知Ksp[Ca3(PO4)2]=2×10-29)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com