
已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3 B.CuCO3<Cu(OH)2<CuS
C.CuS<CuCO3<Cu(OH)2 D.Cu(OH)2<CuCO3<CuS
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源:2015届湖北省黄石市高二上学期期末考试化学试卷(解析版) 题型:选择题
分别将下列物质:①FeCl3②CaO③NaCl④Ca(HCO3)2⑤Na2SO3⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是
A.②③ B.③⑥ C.①④ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
下列表述中正确的是
A.任何能使熵值增大的过程都能自发进行
B.△H<0,△S>0的化学反应一定能自发进行
C.已知热化学方程式2SO2(g)+O2(g) 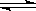 2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是
物质 | X | Y | Z | W |
初始浓度/mol·L-1 | 0.5 | 0.6 | 0 | 0 |
平衡浓度/mol·L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-离子浓度分别为A mol·L-1与B mol·L-1,则A和B的关系为
A.A>B B.A=10-4B C.B=10-4A D.A=B
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列表述中正确的是
A.任何能使熵值增大的过程都能自发进行
B.△H<0,△S>0的化学反应一定能自发进行
C.已知热化学方程式2SO2(g)+O2(g)  2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g) △H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
D.稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列表述不正确的是
A.对于一个确定的反应来说,平衡常数的数值越大,反应限度越大
B.铝热反应会放出大量的热,因此常温下就能顺利发生
C.碳酸铵[(NH4)2CO3]在室温下就能自发地分解产生氨气,碳酸铵分解是因为生成了易挥发的气体,使体系的熵增大
D.对于化学反应COCl2(g) CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率
CO(g)+Cl2(g) ΔH<0当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率
查看答案和解析>>
科目:高中化学 来源:2015届湖北省三校高二上学期期末联考化学试卷(解析版) 题型:选择题
下列叙述中正确的有
①燃烧热是指1 mol可燃物完全燃烧生成氧化物时所释放的能量
②某反应的△H=+100kJ/mol,可知该反应的正反应活化能比逆反应活化能大100kJ/mol
③碳酸铵在室温条件下能自发分解产生氨气,是因为生成了气体,体系的熵增大
④强电解质水溶液的导电能力一定比弱电解质水溶液的导电能力强
⑤Mg比Al活泼,在Mg和Al形成的原电池中,Mg必定做负极
⑥轮船的船壳水线以下常装有一些锌块,这是利用了牺牲阳极的阴极保护法进行保护
A.3 B.4 C.5 D.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com