
| A、1molKOH的摩尔质量为56g |
| B、64gSO2中含有1molO2 |
| C、1molNH3的体积为22.4L |
| D、0.5molCO约含有3.01×1023个CO分子 |
| m |
| M |
| m |
| M |
| N |
| NA |
| 64g |
| 64g/mol |


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
| A、液氨中含有NH3、NH4+、NH2- |
| B、一定温度下,液氨中,c(NH4+)?c(NH2-)是一个常数 |
| C、液氨的最离达到平衡时c(NH3)=c(NH4+)=c(NH2-) |
| D、只要不加入其他物质,液氨中一定有c(NH4+)=c(NH2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D、1 mol甲基中电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,18gH2O所含原子数为NA |
| B、常温常压下,11.2L氧气含原子数为NA |
| C、2.3g金属钠变为钠离子失去0.1NA电子 |
| D、在同温同压时,相同体积的任何气体单质都含有相同数目的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14N、N4与N2互为同位素 |
| B、N4H4(SO4)2的电离方程式为N4H4(SO4)2?N4H44++2SO42- |
| C、NH4+与SO42-中心原子的杂化方式均为“sp3”杂化 |
| D、N4H4(SO4)2中只含有共价键,不含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、中子数为20的氯原子:
| ||||
| B、硫酸的电离方程式:H2SO4=H22++SO42- | ||||
| C、漂白粉的有效成分:CaCl2 | ||||
D、铝离子结构示意图: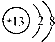 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、283kJ |
| B、110kJ |
| C、196.5kJ |
| D、56.6kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com