
| A. | 0.3 mol/L Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol | |
| B. | 当1L水吸收22.4LNH3时所得氨水的浓度不是1 mol/L,只有当22.4L NH3溶于水制得1L氨水时,其浓度才是1 mol/L | |
| C. | 10℃时0.5 mol/L的稀盐酸100mL,蒸发掉5g水,冷却到10℃时,其体积小于100mL,它的物质的量浓度大于0.5 mol/L | |
| D. | 10℃时0.5 mol/L的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.5 mol/L |
分析 A.缺少溶液体积,无法计算溶液中钠离子和硫酸根离子的物质的量;
B.没有告诉在标准状况下,无法计算氨气的物质的量;
C.蒸发过程中HCl挥发,导致氯化氢的物质的量减少;
D.饱和溶液中,温度相同时氯化钾的物质的量浓度不变.
解答 解:A.没有注明溶液的体积,在1L0.3 mol/L Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol,故A错误;
B.当标准状况下的22.4L NH3溶于水制得1L氨水时,其浓度才是1 mol/L,故B错误;
C.蒸发水时,HCl也会挥发,其浓度会小于0.5 mol/L,故C错误;
D.饱和溶液蒸发水后,恢复到原来的温度还是饱和溶液,其浓度不变,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意掌握标准状况下气体摩尔体积的使用条件,试题培养了学生的分析能力及化学计算能力.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 将pH=3 的①溶液与pH=11的②溶液等体积混合,溶液pH>7 | |
| B. | 若三种溶液浓度相同,将溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| C. | 将①、②等浓度体积混合,混合液中c(CH3COO-)+c(CH3COOH)═c(Na+) | |
| D. | 若②、③的pH值相同,则两种溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当有10NA个电子转移时,该反应放出1300kJ的能量 | |
| B. | 当有10NA个碳氧共用电子对生成时,放出1300kJ的能量 | |
| C. | 当有2NA个碳氧共用电子对生成时,放出1300kJ的能量 | |
| D. | 当有1NA个水分子生成且为液体时,吸收1300kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化剂与还原剂的物质的量之比为8:1 | |
| B. | 还原产物为NH4+ | |
| C. | 若有1molNO3-参加还原反应,则转移3mol e- | |
| D. | 若把该反应设计为原电池,则负极反应为 Fe2+-e _=Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能发生丁达尔效应的分散系有氯化钠溶液、水等 | |
| B. | 在1 L 2 mol•L-1 Fe(OH)3胶体中,含有的Fe(OH)3胶体粒子数为2NA | |
| C. | 在Fe(OH)3胶体中滴入少量稀硫酸将有沉淀产生 | |
| D. | 淀粉胶体中含有少量的NaCl,可用适量AgNO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3为非极性分子 | |
| B. | NCl3跟水反应的产物为NH3和HClO | |
| C. | NCl3跟水反应生成NH4Cl、O2和Cl2 | |
| D. | 在NCl3分子中N为+3价,跟水发生水解反应的产物是HNO2和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 | B. | 1.3 | C. | 3.1 | D. | 0.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 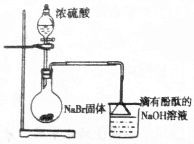 能证明制取HBr的现象使烧杯中红色褪去 | |
| B. | 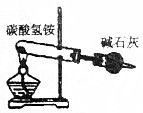 实验室可用此装置制取氨气 | |
| C. | 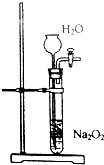 可以用于实验室制取氧气 | |
| D. | 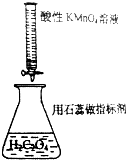 用KMnO4滴定H2C2O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com