
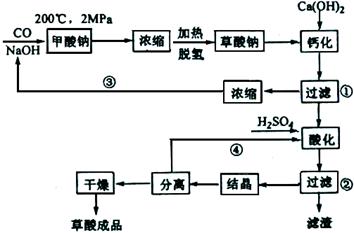
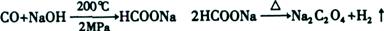
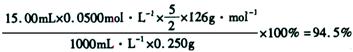
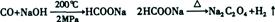 试题分析:(1)根据流程图知,200℃、2MPa条件下,一氧化碳和氢氧化钠反应生成甲酸钠,加热条件下,甲酸钠脱氢生成草酸钠和氢气,反应方程式分别为:
试题分析:(1)根据流程图知,200℃、2MPa条件下,一氧化碳和氢氧化钠反应生成甲酸钠,加热条件下,甲酸钠脱氢生成草酸钠和氢气,反应方程式分别为:

科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
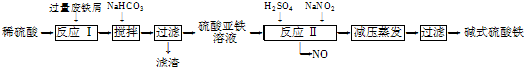
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
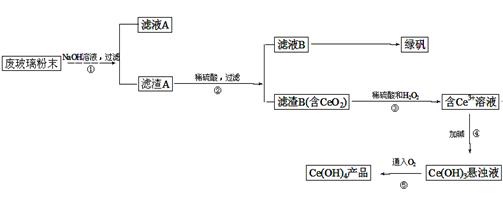
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某溶液中加入盐酸后产生能使澄清石灰水变浑浊的无色无味气体,则该溶液一定含有CO32- |
| B.向饱和Na2CO3溶液中通入足量的CO2后溶液变浑浊,是因为析出了NaHCO3晶体 |
| C.向某溶液中加入适量新制氯水和几滴KSCN溶液后呈红色,则该溶液一定含有Fe2+ |
| D.向某溶液中滴加BaCl2溶液后产生不溶于稀硝酸的白色沉淀,则该溶液一定含有Ag+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
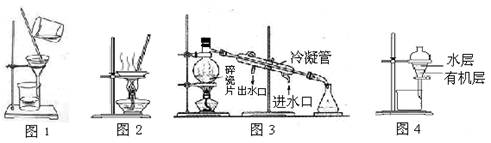
| A.用图1 所示装置除去Fe(OH)3胶体中含有的少量FeCl3杂质 |
| B.用图2 所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.用图3 所示装置从海水制取蒸馏水 |
| D.用图4 所示装置分离酒精萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①→③→⑤→②→④ | B.②→①→③→④→⑤ |
| C.②→④→①→③→⑤ | D.③→①→②→⑤→④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com