
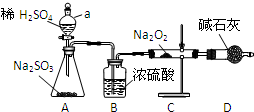

分析 (1)A中反应为浓硫酸和亚硫酸钠反应生成二氧化硫气体,仪器a为添加溶液的分液漏斗,B中浓硫酸具有吸水性;
(2)根据二氧化硫的还原性和过氧化钠的氧化性分析,强氧化性的物质和强还原性的物质发生氧化还原反应,写出相应的方程式;
硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子.
解答 解:(1)A中反应为浓硫酸和亚硫酸钠反应生成二氧化硫气体,反应的化学方程式为:H2SO4+Na2SO3=Na2SO4+H2O+SO2↑,仪器a为添加溶液的分液漏斗,B中浓硫酸具有吸水性,干燥生成的二氧化硫气体,
故答案为:H2SO4+Na2SO3=Na2SO4+H2O+SO2↑; 分液漏斗;干燥SO2;
(2)假设1:只有Na2SO3; 假设2:只有Na2SO4;所以假设3为有Na2SO3和Na2SO4,
故答案为:有Na2SO3和Na2SO4;
①二氧化硫有还原性,过氧化钠有强氧化性,所以二氧化硫能被过氧化钠氧化,二氧化硫和过氧化钠反应的方程式为:Na2O2+SO2=Na2SO4 ,
故答案为:Na2O2+SO2=Na2SO4;
②硝酸有强氧化性会将亚硫酸钡氧化成硫酸钡,所以该方案不合理,故答案为:否;硝酸有强氧化性会将亚硫酸钡氧化成硫酸钡.
点评 本题考查了二氧化硫性质的实验,题目难度中等,会设计探究实验,根据实验现象得出正确结论,掌握基础是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 除去KC1中的K2CO3,可先加入过量的BaCl2溶液,待沉淀完全后再过滤、洗涤,取滤液蒸发即可 | |
| B. | 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 | |
| C. | 用冷却结晶的方法提纯含有少量KC1的KNO3 | |
| D. | 通过点燃可除去CO2中混有的CO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
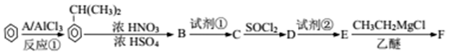
 $→_{H+}^{KMnO_{4}}$
$→_{H+}^{KMnO_{4}}$
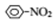 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$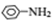 苯胺:弱碱性,易氧化
苯胺:弱碱性,易氧化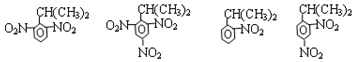 (写出一种的结构简式).
(写出一种的结构简式). .
.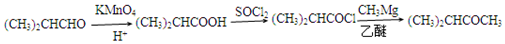 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
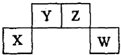 短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )
短周期元素X、Y、Z、W在周期表中的位置关系如图,X元素的单质既能与强酸反应,又能与强碱反应.下列说法正确的是( )| A. | 常温下X的单质投入浓硫酸中没有明显现象 | |
| B. | Y的氢化物只有一种 | |
| C. | W的氧化物对应的水化物一定是强酸 | |
| D. | Z的氧化物排放不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑨ | ⑦ | ⑧ |
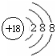 .
.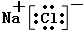
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中氯气既是氧化剂又是还原剂 | |
| B. | KCl既是氧化产物又是还原产物 | |
| C. | 该反应中的氧化剂只有KOH | |
| D. | 氧化产物与还原产物物质的量之比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在pH=0的溶液中:Na+、K+、MnO4-、I- | |
| B. | 中性溶液中:K+、SO42-、Fe3+、Na+ | |
| C. | c(H+)/c(OH-)=10-3的溶液中:Na+、K+、CO32-、S2- | |
| D. | 水电离出的H+为10-12溶液:K+、NH4+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO | B. | N2 | C. | C2H4 | D. | HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com