
现有常温下的四种溶液(如下表),下列有关叙述中正确的是
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.温度下降10℃,四种溶液的pH均不变
C.分别加水稀释10倍、四种溶液的pH:①>②>④>③
D.将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c (OH-) >c(H+)
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
关于下列四个图像的说法中正确的是

A.图①表示可逆反应 “CO(g) + H2O(g) CO2(g)+H2(g)”中的ΔH小于0
CO2(g)+H2(g)”中的ΔH小于0
B.图②是在长时间电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定
为1︰1
C.图③表示可逆反应“A2(g)+3B2(g) 2AB3(g)”的ΔH大于0
2AB3(g)”的ΔH大于0
D.图④表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学学习和研究的说法错误的是
A、化学模型有助于解释一些化学现象 B、质量守恒定律是大量实验事实的总结
C、化学家提出的假设都能被实验证实 D、化学基本原理的应用是有一定条件的
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023mol-1,下列说法中正确的是
A、1.0L 1.0mol·L-1CH3COOH溶液中,CH3COOH分子数为6.02×1023
B、 Na与H2O反应生成1.12L H2(标准状况),反应中转移的电子数为6.02×1023
C、32 g S8单质中含有的S—S键个数为6.02×1023 
D、22.4 L N2中所含的分子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表反映了元素性质的周期性变化规律。请根据元素性质及题给信息回答下列问题:
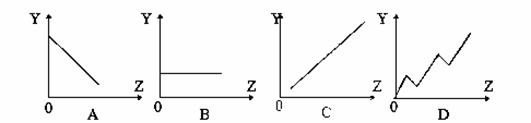
⑴下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的最高正化合价 ;
②第三周期主族元素的最高价氧化物对应水化物的碱性 ;
⑵某同学得到两张有关几种短周期元素信息的表格:
表一
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
表二
| 元素代号 | 元素特征信息 |
| A | 其单质是密度最小的物质。 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一。 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B元素可以形成两种以上的离子化合物。 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
①上述两张表格中,指的是同种元素的是__________________________。(填元素代号)
②在两张表格中,非金属性最强的元素原子的电子排布式为 ;金属性最强的元素位于周期表的第 周期 族。
③写出A、B、C形成的化合物的电子式
④在短周期主族元素中,E元素及与其相邻元素的原子半径从大到小的顺序是
(用元素符号表示)。
⑤QT2形成的化合物在固态时为_________晶体。
⑥请写出一个能说明D与L金属性强弱的事实______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的原子最外电子层排布是5s25p1,该元素或其化合物不可能具有的性质是 ( )
A.该元素单质是导体 B.该元素单质在一定条件下能与盐酸反应
C.该元素的氧化物的水合物显碱性 D.该元素的最高化合价呈+5价 ( )
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1NaOH溶液
(1)若实验中大约要使用470 mL NaOH溶液,至少需要称量NaOH固体___________g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):____________。
| 名称 | 托盘天平 | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |
|
|
|
|
|
|
| 序号 | a | b | c | d | e | f |
Ⅱ.测定中和热
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、盐酸、NaOH溶液,尚缺少的实验玻璃用品是____________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
| 起始温度t1/℃ | 终止温度 | 温度差平均值 | |||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 |
②近似认为0.50 mol·L-1NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=“4.18”J/(g·℃)。则中和热ΔH= __________(取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)_____________。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
反应3X(g)+Y(g) 2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率υ为( )
A. υ(X)=0.05mol·L—1·min—1 B. υ(Y)= 0.10mol·L—1·min—1
C. υ(Z)=0.10mol·L—1·min—1 D. υ(W)=0.05mol·L—1·s—1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com