
下列关于化学学习和研究的说法错误的是
A、化学模型有助于解释一些化学现象 B、质量守恒定律是大量实验事实的总结
C、化学家提出的假设都能被实验证实 D、化学基本原理的应用是有一定条件的
科目:高中化学 来源: 题型:
写出下列反应的化学方程式,并指明反应类型。
丙烷的燃烧反应 ;
乙烯与水的反应 ;
聚丙烯的合成 ;
苯的溴代 ;
甲苯与足量氢气反应 ;
乙炔与氯化氢的反应(1:1) ;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH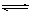 CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大
CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大
B.25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O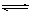 H++OH-逆向移动,c(H+)降低
H++OH-逆向移动,c(H+)降低
C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.已知25℃时部分弱电解质的电离平衡常数数据如下表
| 化学式 | 电离常数(25 ℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | Ka1=4.3×10-7、K a2=5.6×10-11 |
| H2SO3 | Ka1=1.0×10-2、K a2=1.02×10-7 |
 (1)25 ℃时,物质的量浓度均为0.1mol•L-1的四种溶液:a.NaCN溶液 b.Na2CO3溶液c.CH3COONa溶液 d.NaHCO3溶液 , pH由大到小的顺序为________________________。(用字母表示)。
(1)25 ℃时,物质的量浓度均为0.1mol•L-1的四种溶液:a.NaCN溶液 b.Na2CO3溶液c.CH3COONa溶液 d.NaHCO3溶液 , pH由大到小的顺序为________________________。(用字母表示)。
(2)向NaCN溶液中通入少量的CO2,发生反应的离子方程式为_________________ _
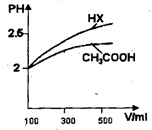
(3)体积均为100 mL、pH均为2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如上图所示,则HX的电离平衡常数_______(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
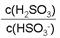 (4)25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中 将_ ___ (填“增大”、“减小”或“不变”)
(4)25℃时,若向NaHSO3溶液中加入少量的I2,则溶液中 将_ ___ (填“增大”、“减小”或“不变”)
Ⅱ(5)过氧化尿素(CO(NH2)2·H2O2)是一种新型漂白、消毒剂,其活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品2.000g,溶解于水,在250mL容量瓶中定容,准确量取其中25.00mL溶液于锥形瓶中,加入1mL 6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2(KMnO4溶液不与尿素反应),至滴入最后一滴时,溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4溶液6.000mL:
 完成并配平下列化学方程式:
完成并配平下列化学方程式:
MnO4— + H2O2 + H+ = Mn2+ + H2O +
② KMnO4溶液应盛放在 滴定管中,若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量 (填“偏高”、“偏低”或“不变”);
③根据滴定结果确定产品质量 (填“合格”或“不合格”),活性氧的质量分为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为证明某可溶性一元酸(HX)是弱酸,同学们设计了如下实验方案。其中不合理的是
A.室温下,测0.1mol/L HX溶液的pH ,若pH>1,证明HX是弱酸
B.室温下,测1mol/L NaX溶液的pH ,若pH>7,证明HX是弱酸
C.将等浓度、等体积HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸
D.在相同条件下,对0.1 mol/L的盐酸和0.1mol/L的HX溶液进行导电性实验,两者相比较HX溶液灯泡相对较暗,证明HX为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温下的四种溶液(如下表),下列有关叙述中正确的是
| ① | ② | ③ | ④ | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| pH | 11 | 11 | 3 | 3 |
A.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
B.温度下降10℃,四种溶液的pH均不变
C.分别加水稀释10倍、四种溶液的pH:①>②>④>③
D.将①、④两种溶液等体积混合,所得溶液中:c(NH4+)>c(Cl-)>c (OH-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
电子在原子核外排布时,必须遵循的原则是; ( )
① 电子排布在同一能级时,总是优先单独占据不同轨道,且自旋方向相同
② 电子排布在不同能级时,总是优先占据能量低的轨道,然后再占据能量高的轨道
③ 电子排布在同一轨道时,最多只能排2个,且自旋方向必须相反
④ 电子的排布总是遵循“能量最低原理”“泡利不相容原理”和“洪特规则”
A.①② B。②④ C。①③ D..②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: 
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是 ,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是 ,最高价氧化物水化物显两性的氢氧化物的化学式是 。
(2)③与④的气态氢化物的稳定性由大到小的顺序是 。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
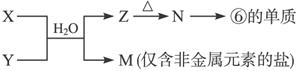
X溶液与Y溶液反应的离子方程式为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com