
【题目】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业. 
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJmol﹣1CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJmol﹣1
2CO(g)+O2(g)═2CO2(g)△H3=c kJmol﹣1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=kJmol﹣1 .
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示. ①a点所代表的状态(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是 .
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2CO+H2O△H>0,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到如下数据图2、①由图2得,最佳空间流率为h﹣1; ②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,
催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
试说明不选择单组份ZnO原因是 .
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示: ①该进行的反应的△S0(填:“>”或“<”)
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示: ①该进行的反应的△S0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP= .
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是(列举2项).
【答案】
(1)(a+2b﹣2c)
(2)不是;b、c点均未达到平衡状态,c点温度高,反应速率较快,故CO2的转化率较大
(3)3600;使用单组分ZnO时反应速率虽然快,但是由图3可知,二氧化碳转化率、甲醇的产率都过低,实际生产中没有意义,故不采用
(4)<;![]() ;增大压强;提高氢气和二氧化碳物质的量的比值
;增大压强;提高氢气和二氧化碳物质的量的比值
【解析】解:(1)已知:①CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJmol﹣1②CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJmol﹣1
③2CO(g)+O2(g)═2CO2(g)△H3=c kJmol﹣1 ,
根据盖斯定律,①+②×2﹣2×③可得:CO2(g)+CH4(g)═2CO(g)+2H2(g),则△H=(a+2b﹣2c)kJmol﹣1 ,
所以答案是:(a+2b﹣2c);(2)①催化剂只能改变反应速率,不能改变化学平衡,所以不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下达平衡时CO2的转化率相同,故a点所代表的状态不是平衡状态,
所以答案是:不是;
②b、c点均未达到平衡状态,c点温度高,反应速率较快,故CO2的转化率较大;
所以答案是:b、c点均未达到平衡状态,c点温度高,反应速率较快,故CO2的转化率较大;(3)①由图可知,在3600h﹣时,二氧化碳转化率最大,甲醇产量最大,流动速率高会消耗能量,故最佳流动速率为3600h﹣ ,
所以答案是:3600;
②使用单组份ZnO时反应速率虽然最快,但是由图3可知,CO2转化率、CH3OH产率均过低实际生产中没有意义,故不采用,
所以答案是:使用单组分ZnO时反应速率虽然快,但是由图3可知,二氧化碳转化率、甲醇的产率都过低,实际生产中没有意义,故不采用;
③由图可知,在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,反应速率加快,不影响平衡移动,不可能是升高温度,且改变条件浓度也不变,不可能是增大压强,可能是加入催化剂,
所以答案是:加入催化剂;(4)①反应是气体物质的量减小的反应,混乱度减小,则△S<0,所以答案是:<;
②该反应的Kp等于各产物平衡分压系数次方的乘积和各个反应物平衡分压系数次方乘积的比值,即KP= ![]() ,
,
所以答案是: ![]() ;
;
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是增大压强或提高氢气和二氧化碳物质的量的比值,
所以答案是:增大压强;提高氢气和二氧化碳物质的量的比值.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】原子总数、价电子总数都相等的微粒称为等电子体。下列各组微粒中不能互称为等电子体的是 ( )
A.CH4、NH4+B.H2S、HCl
C.CO2、N2OD.CO、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.决定化学反应速率的主要因素是参加反应的物质的性质
B.催化剂可以使不起反应的物质发生反应
C.可以找到一种催化剂使水变成汽油
D.催化剂是决定化学反应速率的主要因素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列方法均可制得氧气: ①2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
②2HgO ![]() 2Hg+O2↑
2Hg+O2↑
③2KMnO4 ![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
④2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为( )
A.3:1:1:2
B.2:2:2:1
C.3:1:4:2
D.2:1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3在工业生产上有重要的应用
(1)写出用浓氨水检验氯气管道泄漏的化学反应方程式
(2)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480mL0.5molL﹣1 NaOH溶液以备使用. 
(1)该同学应选择mL的容量瓶.使用容量瓶前必须进行的一步操作是
(2)其操作步骤如下图所示,则如图操作应在下图中的(填选项字母)之间.
A.②与③
B.①与②
C.④与⑤
(3)该同学应称取NaOH固体g
(4)下列操作对所配溶液的浓度大小有何影响?用“偏高”“偏低”或“无影响”填空: ①定容时俯视刻度线:;
②摇匀后,液面低于刻度线,没有再加水: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质随着原子序数的递增呈现周期性变化的原因是
A. 元素原子的核外电子排布呈周期性变化
B. 元素原子的最外层电子排布呈周期性变化
C. 元素的化合价呈周期性变化
D. 元素原子半径呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读、分析下列两个材料:
材料一、如图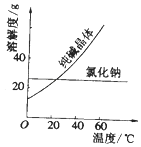
材料二
物质 | 熔点/℃ | 沸点/℃ | 密度/gcm﹣3 | 溶解性 |
乙二醇( C2H6O2) | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题:
(1)要从氯化钠和纯碱的固体混合物中分离得到纯净的氯化钠,应先将固体溶解,再经过、洗涤、干燥等操作.
(2)将乙二醇和丙三醇相互分离的最佳方法是 , 写出该方法在操作上的注意事项(写出一项) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com