
【题目】锰单质及其化合物应用十分广泛。回答下列问题:
(1)Mn在元素周期表中的位置为__,基态Mn原子的价电子排布式为__。
(2)MnCl2可与NH3反应生成[Mn(NH3)6]Cl2,新生成的化学键为__键。NH3分子的空间构型为__,其中N原子的杂化轨道类型为__。
(3)金属锰有多种晶型,其中δMn的结构为体心立方堆积,晶胞参数为αpm。δMn中锰的原子半径为__pm。已知阿伏加德罗常数的值为NA,δMn的理论密度ρ=__gcm3。(列出计算式)
(4)已知锰的某种氧化物的晶胞如图所示,该氧化物的化学式为__,锰离子的配位数为__。
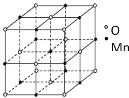
【答案】第四周期第ⅦB族 3d54S2 配位键 三角锥形 sp3 ![]()
![]() MnO 6
MnO 6
【解析】
(1)Mn是25号元素,根据能量最低原理书写基态Mn原子的价电子排布式;
(2)MnCl2与NH3通过配位键结合为[Mn(NH3)6]Cl2。NH3分子中N原子价电子对数是4,有1对孤电子对;
(3)体心立方堆积,体对角线=4r;
(4)根据均摊原则计算该氧化物的化学式。
(1) Mn是25号元素,在元素周期表中的位置是第四周期第ⅦB族;根据能量最低原理,基态Mn原子的价电子排布式是3d54S2;
(2)MnCl2与NH3通过配位键结合为[Mn(NH3)6]Cl2,新生成的化学键为配位键。NH3分子中N原子价电子对数是4,有1对孤电子对,NH3分子的空间构型为三角锥形;其中N原子的杂化轨道类型为sp3。
(3)δMn的结构为体心立方堆积,晶胞参数为αpm,则晶胞的体对角线=![]() pm,体对角线=4r,δMn中锰的原子半径为
pm,体对角线=4r,δMn中锰的原子半径为![]() pm。δMn的1个晶胞含有Mn原子数
pm。δMn的1个晶胞含有Mn原子数![]() ,密度ρ=
,密度ρ=![]() gcm3。
gcm3。
(4)根据均摊原则,该晶胞含有氧离子数是![]() 、Mn离子数是
、Mn离子数是![]() ,该氧化物的化学式为MnO,锰离子周围有6个距离最近且相等的氧离子,锰离子的配位数为6。
,该氧化物的化学式为MnO,锰离子周围有6个距离最近且相等的氧离子,锰离子的配位数为6。


科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是
A. 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B. 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C. 由氯代环己烷消去制环己烯;由丙烯加溴制![]() 二溴丙烷
二溴丙烷
D. 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过实验得出的结论正确的是( )
A.用铂丝蘸取待测液放在火焰上灼烧,火焰呈黄色,则原溶液中含Na+不含K+
B.向待测液中加氯化钡溶液,生成白色沉淀,再加稀盐酸,沉淀不溶解,则原溶液中含有SO![]()
C.向待测液中加稀盐酸,生成无色无味气体,则溶液中含CO![]()
D.向待测液中加NaOH溶液,有白色沉淀生成,继续加入NaOH溶液,沉淀全部溶解,则原溶液中可能含Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铅酸蓄电池充电时的阳极反应:PbSO4+2H2O+2e-=PbO2+4H++![]()
B.用惰性电极电解氯化铜溶液2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.少量的Mg(HCO3)2溶液加过量的Ba(OH)2溶液的离子方程式为: Mg2++2![]() +2Ba2++4OH-=2BaCO3↓+Mg(OH)2↓+2H2O
+2Ba2++4OH-=2BaCO3↓+Mg(OH)2↓+2H2O
D.HS-的水解方程式:HS-+H2OH3O++S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,放电时反应为:2Zn+O2+4OH-+2H2O=2![]() 。下列说法正确的是
。下列说法正确的是
A.放电时,正极反应为:Zn+4OH--2e-=![]()
B.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
C.充电时,电解质溶液中c(OH-)逐渐增大
D.充电时,电子的运动方向为:电源负极→电解池阴极→电解质溶液→电解池阳极→电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机反应方程式书写正确且为加成反应的是( )
A.CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B.CH2=CH2+Br2→CH3-CHBr2
C.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
D.![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有机物完全燃烧,生成CO2和H2O。将12g该有机物的完全燃烧产物通过浓硫酸,浓硫酸增重14.4g,再通过碱石灰,碱石灰增重26.4g。则该有机物的分子式为
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年发明的。此方法具有食盐利用率高、对环境的污染少、生产成本低等优点。其制备中涉及如下两个反应:NaC1+H2O+CO2+NH3===NaHCO3↓+NH4Cl、2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)基态氯原子的电子排布式为______,C、N、O三种元素第一电离能由大到小的顺序为____。
(2)①H2O、CO2、NH3三种分子中属于V形分子的是_______。
②在常温常压下,1体积水可溶解700体积NH3、可溶解0.8体积CO2,试解释其原因:_________。
(3)Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是________(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是________。
(4)①要确定Na2CO3固体是晶体还是非晶体,最可靠的方法是_____。
②下列事实不能支持Na2CO3的晶体类型为离子晶体的是______(填字母)。
a.熔点为851℃ b.晶体中存在Na+、CO![]()
c.可溶于水 d.晶体中存在离子键,共价键
(5)钠、氧两元素可形成两种常见化合物,其中一种的晶胞如下图所示,则该氧化物的化学式为________,若晶胞参数为d pm,晶胞的密度为![]() ,则阿伏加德罗常数NA=______(用含d、ρ的代数式表示)。
,则阿伏加德罗常数NA=______(用含d、ρ的代数式表示)。
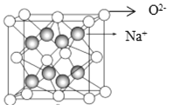
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com