
【题目】如图是一组检验氯气性质的装置。
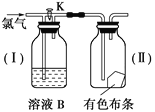
(1)现关闭活塞K,若有色布条是干燥的,溶液B为浓硫酸,则有色布条________;若溶液B为水,则有色布条________;若溶液B为饱和的NaHCO3溶液,则有色布条________。
(2)现打开K,溶液B为氢氧化钠溶液,通入的Cl2是湿润的,布条是干燥的,则有色布条________。
科目:高中化学 来源: 题型:
【题目】氮化锂是一种优良的贮氢材料,它是一种紫色或红色的晶状固体,在空气中长期暴露,最终会变成碳酸理。氮化理易水解生成氢氧化锂和氨气,在空气中加热能剧烈燃烧,特别是细粉末状的氮化锂: 锂与氨反应生成LiNH2和H2实验室用以下装置制取干燥、纯净的N2并与金属锂(密度为0.534g/cm3) 反应制取氮化锂。

回答下列问题:
(1)连接好装置进行实验前必须______________
(2)实验步骤如下:
①装药品 ②点燃C处酒精灯 ③点燃E处酒精灯 ④打开A中分液漏斗
正确的先后顺序为________(填序号)
(3)装置A是制备氨气的简易装置烧瓶中固体是:_______;D装置的作用是_______.
(4)写出C中化学方程式为___________
(5)将12.0g锂放入E反应,实验结束后称得E装置增加了7.0g,计算生成氮化锂的质量分数为________(结果保留一位小数)。
(6)设计简单实验证明E中产物为氮化锂:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原料药合成路线如下:
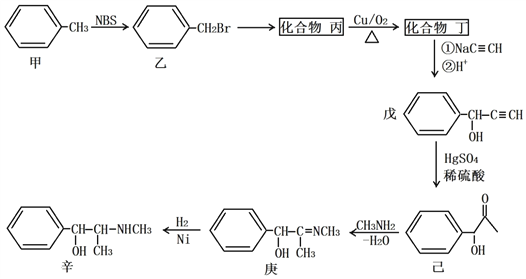
(1)甲→乙的反应类型为_______________;乙→丙的反应条件为__________________。
(2)丁的名称为_______________;戊的分子式为__________________。
(3)丁发生银镜反应的化学方程式为___________________________________________;己→庚的化学方程式为___________________________________________。
(4)化合物己的芳香族同分异构体有多种,A和B是其中的两类,它们的结构和性质如下:
①已知A遇FeC13溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则A的结构简式可能为________________或________________。
②已知B中含有甲基,能发生水解反应,苯环上只有一个取代基,则B的结构有___种。
(5)丁烯酮(![]() )可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC≡CH)为原料(无机试剂任选),设计制备丁烯酮的合成路线:___________________。
)可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC≡CH)为原料(无机试剂任选),设计制备丁烯酮的合成路线:___________________。
合成路线流程图示例如:A ![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
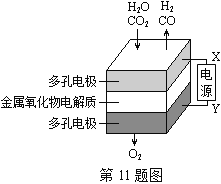
A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g)+I2(g) ![]() 2HI(g) △H=-a kJ/mol.已知:
2HI(g) △H=-a kJ/mol.已知:
![]() (a、b、c均大于零)。
(a、b、c均大于零)。
下列说法正确的是
A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2 (g)和2 mol I2 (g),充分反应后放出的热量为2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。下列说法不正确的是

A. 除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B. 图中b点碳酸钙的结晶速率大于其溶解速率
C. 通过蒸发,可使溶液由a点变化到c点
D. 在25℃时,反应CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)的平衡常数K=3250
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为________L,NO2的体积为________L。
(2)待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中Cu2+全部转化成沉淀,则原硝酸溶液的浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3+具有较强的氧化性,能氧化SO2 。为验证该反应,用1 mol· L-1 FeCl3溶液与SO2进行实验。
(1)Fe3+氧化SO2的反应表示为 M。向黄色FeCl3溶液中通入SO2后,预期的实验现象是__________
(2)用如下图所示装置进行实验。
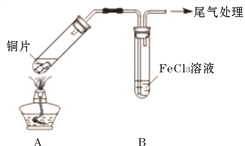
①将A装置加热,反应的化学方程式是____________
②A中产生的气体通入B中后,溶液变为红色。为证明B中Fe3+氧化了SO2,进行如下两个实验方案的实验:
I 取B中红色溶液,加入铁氰化钾溶液,有蓝色沉淀生成,Fe3+与SO2发生氧化还原反应的离子方程式是____________。
II取B中红色溶液,加入用盐酸酸化的BaCl2溶液,有白色沉淀,证明B中Fe3+氧化了SO2。比较I和II实验方案,哪个方案更好,理由是___________。
(3)已知:B中溶液变红的反应:Fe3++6SO2 ![]() Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
Fe(SO2)63+(红色 )K=1 表示为N证明该反应是可逆反应的实验操作是___________。
(4)向1 mol· L-1 FeCl3溶液通入足量SO2,溶液很快变为红色;停止通入SO2,静置;15分钟后溶液逐渐变为黄色;60分钟后变为浅绿色。说明B中既发生反应M,也发生了反应N。结合反应速率和平衡移动原理解释溶液很快变红,最终变浅绿的原因____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com