
【题目】氮化锂是一种优良的贮氢材料,它是一种紫色或红色的晶状固体,在空气中长期暴露,最终会变成碳酸理。氮化理易水解生成氢氧化锂和氨气,在空气中加热能剧烈燃烧,特别是细粉末状的氮化锂: 锂与氨反应生成LiNH2和H2实验室用以下装置制取干燥、纯净的N2并与金属锂(密度为0.534g/cm3) 反应制取氮化锂。

回答下列问题:
(1)连接好装置进行实验前必须______________
(2)实验步骤如下:
①装药品 ②点燃C处酒精灯 ③点燃E处酒精灯 ④打开A中分液漏斗
正确的先后顺序为________(填序号)
(3)装置A是制备氨气的简易装置烧瓶中固体是:_______;D装置的作用是_______.
(4)写出C中化学方程式为___________
(5)将12.0g锂放入E反应,实验结束后称得E装置增加了7.0g,计算生成氮化锂的质量分数为________(结果保留一位小数)。
(6)设计简单实验证明E中产物为氮化锂:_________
【答案】 检查装置气密性 ①④③② 碱石灰或生石灰或固体氢氧化钠 吸收氨气并干燥氮气 3CuO + 2NH3![]() Cu + N2 + 3H2O 92.1% 取少量产物于试管,滴入少量蒸馏水,用镊子夹一块湿润的红色石蕊试纸接近试管口,若试纸变蓝色,则产物有氮化锂,否则不含氮化锂
Cu + N2 + 3H2O 92.1% 取少量产物于试管,滴入少量蒸馏水,用镊子夹一块湿润的红色石蕊试纸接近试管口,若试纸变蓝色,则产物有氮化锂,否则不含氮化锂
【解析】(1)凡是制备气体的实验,在进行实验前,都要检查装置气密性;正确答案:检查装置气密性。
(2)先加入药品,打开分液漏斗的活塞,使试剂滴下,产生氨气,利用氨气排净装置内的空气,然后点燃E处酒精灯,给金属锂预热,再点燃C处酒精灯,让氨气和氧化铜反应生成铜和氮气,产生的氮气再与锂迅速反应;正确答案: ①④③②。
(3)实验室可以用浓氨水和生石灰反应制备氨气,固体为生石灰,也可以为碱石灰、氢氧化钠固体等;吸收反应产生水蒸气,并吸收氨气;正确答案:碱石灰或生石灰或固体氢氧化钠;吸收氨气并干燥氮气。
(4)氨气具有还原性,还原氧化铜得到金属铜,本身被氧化为氮气;正确答案:3CuO + 2NH3![]() Cu + N2 + 3H2O。
Cu + N2 + 3H2O。
(5) E装置增加7.0g,说明氮气的质量为7.0g,物质的量为0.25mol,反应的反应为:6Li+N2= 2Li3N,生成氮化锂的质量为0.5×35=17.5g,消耗金属锂质量0.25×6×7=10.5g,剩余金属锂12-10.5=1.5g,最终固体混合物总质量为1.5+17.5=19g,氮化锂的质量分数为:17.5÷19×100%=92.1%;正确答案:92.1%。
(6)氮化理易水解生成氢氧化锂和氨气,生成的氨气为碱性气体,然后再用湿润的红色石蕊试纸进行检验,如果试纸变为蓝色,结论得证;正确答案:取少量产物于试管,滴入少量蒸馏水,用镊子夹一块湿润的红色石蕊试纸接近试管口,若试纸变蓝色,则产物有氮化锂,否则不含氮化锂。


科目:高中化学 来源: 题型:
【题目】在一定温度和压强下,将装有N2和NO2混合气体的试管倒立在水中,经足够的时间后,试管内气体的体积缩小为原体积的3/5,则原混合气体中N2和NO2体积比是
A. 2/3 B. 3/2 C. 3/5 D. 5/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】定量分析是化学实验中重要的组成部分。
Ⅰ.中和热的测定:
(1)在实验室中,用50 mL 0.40 mol/L的盐酸与50 mL 0.50mol/L的NaOH溶液反应测定和热。假设此时溶液密度均为1 g/cm3,生成溶液的比容热c = 4.18 J/(g℃),实验起始温度为T1℃,终止温度为T2℃,请写出中和热的计算式(写出最后结果)△H=________________KJ/mol。
(2)1L 1mol/LH2SO4溶液与2L 1mol/LNaOH溶液完全反应,放出114.6 kJ的热量。请写出表示该反应中和热的热化学方程式_________________________________________________。
Ⅱ.氧化还原滴定实验与中和滴定类似。为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。
(1)滴定原理为:______________________________________________(用离子方程式表示)。
(2)滴定时,KMnO4溶液应装在 _____________(填“酸式”或“碱式”)滴定管中。润洗滴定管的操作方法是_____________________________________________________。
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为________mL。
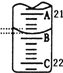
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 24.02 | 23.98 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是由以下选项中的______________引起。
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积
B.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
(5)写出计算H2C2O4的物质的量浓度的最简表达式:C =_______________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
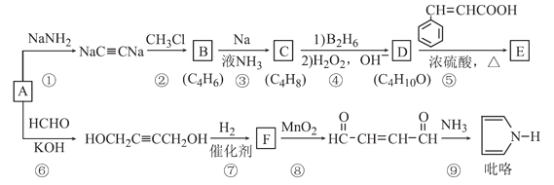
回答下列问题:
(1)A的名称是_________;已知C是反式产物,则C的结构简式为_________。
(2)⑥的反应类型是_________,⑧的反应类型是__________。
(3)F含有的官能团的名称是________。
(4)反应⑤的化学方程式为__________。
(5)肉桂酸(![]() )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是___________。
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是___________。
(6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯(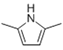 )的合成路线____。
)的合成路线____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol 电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子都达到了8e-稳定结构,该分子的电子式为____________,化学键类型为________________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一组检验氯气性质的装置。
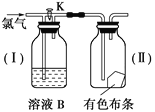
(1)现关闭活塞K,若有色布条是干燥的,溶液B为浓硫酸,则有色布条________;若溶液B为水,则有色布条________;若溶液B为饱和的NaHCO3溶液,则有色布条________。
(2)现打开K,溶液B为氢氧化钠溶液,通入的Cl2是湿润的,布条是干燥的,则有色布条________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com