
【题目】以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
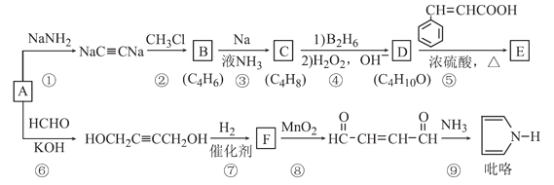
回答下列问题:
(1)A的名称是_________;已知C是反式产物,则C的结构简式为_________。
(2)⑥的反应类型是_________,⑧的反应类型是__________。
(3)F含有的官能团的名称是________。
(4)反应⑤的化学方程式为__________。
(5)肉桂酸(![]() )的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是___________。
)的同分异构体中,含有苯环和碳碳双键,且能够发生水解反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有面积比为2:3的两组峰的有机物的结构简式是___________。
(6)参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯(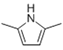 )的合成路线____。
)的合成路线____。
【答案】 乙炔  加成反应 氧化反应 碳碳双键 羟基
加成反应 氧化反应 碳碳双键 羟基  7 CH3CH2OCH2CH3
7 CH3CH2OCH2CH3 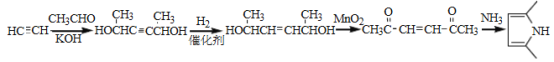
【解析】(1)根据反应①看出,A+NaNH2→NaC≡CNa,该反应为取代反应,所以A为乙炔;正确答案:乙炔。NaC≡CNa与CH3Cl发生取代反应生成C,结简式为:CH3C≡CCH3,其反式结构产物为
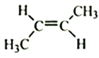 ;正确答案:乙炔;
;正确答案:乙炔; 。
。
(2)根据转化过程看出:乙炔分子中的两个碳氢键断裂,分别与醛基发生加成反应,生成羟基;反应⑧在二氧化锰的作用下,醇羟基氧化为醛基;正确答案:加成反应;氧化反应 。
(3) 根据第⑦反应看出,与氢气发生加成反应,三键变为双键,F含有的官能团名称是碳碳双键、 羟基;正确答案:碳碳双键; 羟基。
(4)根据分子式C4H100看出,它应该为饱和一元醇,该有机物可被氧化成酮,所以该醇中羟基不可能在碳链的端位,该醇只能为2-羟基丁烷,该物质与苯丙烯酸反应生成酯;正确答案: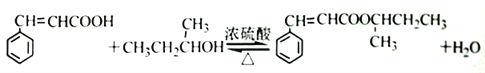 。
。
(5)能够发生水解可以为甲酸某烯酸酯(2种),甲酸酚酯、乙烯基两种取代基(3种),苯甲酸烯醇酯(1种),丙烯酸酚酯(1种),这样得到的满足条件的异构体为7 种; C4H100为饱和一元醇或一元醚的同分异构体,因此根据分子式可以写出符合条件的异构体为:CH3CH2OCH2CH3;正确答案:7;CH3CH2OCH2CH3。
6)乙炔与乙醛在碱性条件下发生反应生成 CH3(HO)CHC≡CCH(OH)CH3,然后再与氢气发生加成反应生成CH3(HO)CHCH=CHCH(OH)CH3, 然后醇被氧化为酮,在氨气作用生成环状的含氮的化合物![]() ;正确答案为:
;正确答案为:


科目:高中化学 来源: 题型:
【题目】下列关于氯水的说法正确的( )
A.新制氯水呈浅黄绿色,是因为氯水中含有HClO
B.新制氯水在光照的条件下,可以产生气体,该气体是氯气
C.新制氯水中滴加硝酸银溶液,没有任何现象
D.新制氯水中滴加石蕊试液,变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产生活中广泛存在。
(1)①氯胺(NH2Cl)的电子式为________。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH=_________。
化学键 | 键能/(kJ·mol-1) |
N-H | 391.3 |
Cl-Cl | 243.0 |
N-Cl | 191.2 |
H-Cl | 431.8 |
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
①该反应为____________(填“放热”或“吸热”)反应。
②乙容器在200min达到平衡状态,则0~200min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_____Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是______(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锂是一种优良的贮氢材料,它是一种紫色或红色的晶状固体,在空气中长期暴露,最终会变成碳酸理。氮化理易水解生成氢氧化锂和氨气,在空气中加热能剧烈燃烧,特别是细粉末状的氮化锂: 锂与氨反应生成LiNH2和H2实验室用以下装置制取干燥、纯净的N2并与金属锂(密度为0.534g/cm3) 反应制取氮化锂。

回答下列问题:
(1)连接好装置进行实验前必须______________
(2)实验步骤如下:
①装药品 ②点燃C处酒精灯 ③点燃E处酒精灯 ④打开A中分液漏斗
正确的先后顺序为________(填序号)
(3)装置A是制备氨气的简易装置烧瓶中固体是:_______;D装置的作用是_______.
(4)写出C中化学方程式为___________
(5)将12.0g锂放入E反应,实验结束后称得E装置增加了7.0g,计算生成氮化锂的质量分数为________(结果保留一位小数)。
(6)设计简单实验证明E中产物为氮化锂:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(都不为零),达到平衡时,X、Y、Z浓度分别为0.1 mol·L-1、0.3 mol·L-1和0.08 mol·L-1,则下列判断不合理的是( )
A. c1∶c2=1∶3
B. 平衡时,Y和Z的生成速率之比为2∶3
C. X和Y的转化率相等
D. c1的取值范围为0<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)常温下为无色液体,是应用广泛的化工原料和前景乐观的燃料。
(1)①己知:CO、H2、CH3OH的燃烧热(△H)分别为﹣283.0 kJmol-1、﹣285.8 kJmol-1、-726.8 kJmol-1,则CO和H2反应生成CH3OH的热化学方程式是________________。
②有人设想综合利用太阳能将天然气转化为较易存运的甲醇,装置如下图,装置工作时阳极反应方程式为_________________________________。

(2)一定温度下反应CO(g)+2H2(g)=CH3OH(g)在容积为2L的密闭容器中进行,其相关数据见上图。
①从反应开始至平衡时,用H2表示化学反应速率为__________,该温度下此反应的平衡常数为__________;
②5min后速率变化加剧的原因可能是___________________________;
(3)在6.98MPa、250℃和催化剂(CoI2)作用下,甲醇可转化为乙酸:
CH3OH(g) + CO(g) = CH3COOH(g)
有机合成常有副反应存在。若反应釜中CH3OH和CO配料比(质量)为1,甲醇生成乙酸的选择率为90.0%,则此反应CO的转化率为___________。
(4)常温Ka(CH3COOH)=1.8×10-5, 0.1 molL-1CH3COOH溶液中滴加0.1 molL-1CH3COONa溶液至 pH=7,此时混合溶液中两溶质的物质的量比n(CH3COOH):n(CH3COONa)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,2 L密闭容器中充入0.40 mol N2O4,发生如下反应:N2O4(g)![]() 2NO2(g)。一段时间后达到平衡,测得数据如下:
2NO2(g)。一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/( mol·L1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
请回答:
(1)20 s内,v(NO2) =_________mol/(L·s) 1。
(2)升高温度时,c(NO2)增大,则正反应是______(选填“放热”或“吸热”)反应。
(3)该温度下反应的化学平衡常数数值为______。
(4)该条件下N2O4的平衡转化率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。下列说法不正确的是

A. 除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B. 图中b点碳酸钙的结晶速率大于其溶解速率
C. 通过蒸发,可使溶液由a点变化到c点
D. 在25℃时,反应CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)的平衡常数K=3250
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com