
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是强酸的酸式盐,在水溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2).AlCl3是强酸弱碱盐,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3
Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
(3).实验室配制FeSO4溶液,因亚铁离子发生水解:Fe2++2H2O![]() Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O
Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,则Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,则Kw=1.0×10-12,故答案为:1.0×10-12;
②在该温度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,两溶液混合后氢氧根离子过量,所得溶液中c(OH-)=![]() = 0.1mol/L,则c(H+)=
= 0.1mol/L,则c(H+)=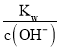 =10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
=10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】水能灭火,水也能生火。下列某种物质包在棉花团中,然后滴加适量的水,棉花团很快燃烧起来。该物质是( )
A. MgO B. Na2O2 C. Al2O3 D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锂是一种优良的贮氢材料,它是一种紫色或红色的晶状固体,在空气中长期暴露,最终会变成碳酸理。氮化理易水解生成氢氧化锂和氨气,在空气中加热能剧烈燃烧,特别是细粉末状的氮化锂: 锂与氨反应生成LiNH2和H2实验室用以下装置制取干燥、纯净的N2并与金属锂(密度为0.534g/cm3) 反应制取氮化锂。

回答下列问题:
(1)连接好装置进行实验前必须______________
(2)实验步骤如下:
①装药品 ②点燃C处酒精灯 ③点燃E处酒精灯 ④打开A中分液漏斗
正确的先后顺序为________(填序号)
(3)装置A是制备氨气的简易装置烧瓶中固体是:_______;D装置的作用是_______.
(4)写出C中化学方程式为___________
(5)将12.0g锂放入E反应,实验结束后称得E装置增加了7.0g,计算生成氮化锂的质量分数为________(结果保留一位小数)。
(6)设计简单实验证明E中产物为氮化锂:_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)常温下为无色液体,是应用广泛的化工原料和前景乐观的燃料。
(1)①己知:CO、H2、CH3OH的燃烧热(△H)分别为﹣283.0 kJmol-1、﹣285.8 kJmol-1、-726.8 kJmol-1,则CO和H2反应生成CH3OH的热化学方程式是________________。
②有人设想综合利用太阳能将天然气转化为较易存运的甲醇,装置如下图,装置工作时阳极反应方程式为_________________________________。

(2)一定温度下反应CO(g)+2H2(g)=CH3OH(g)在容积为2L的密闭容器中进行,其相关数据见上图。
①从反应开始至平衡时,用H2表示化学反应速率为__________,该温度下此反应的平衡常数为__________;
②5min后速率变化加剧的原因可能是___________________________;
(3)在6.98MPa、250℃和催化剂(CoI2)作用下,甲醇可转化为乙酸:
CH3OH(g) + CO(g) = CH3COOH(g)
有机合成常有副反应存在。若反应釜中CH3OH和CO配料比(质量)为1,甲醇生成乙酸的选择率为90.0%,则此反应CO的转化率为___________。
(4)常温Ka(CH3COOH)=1.8×10-5, 0.1 molL-1CH3COOH溶液中滴加0.1 molL-1CH3COONa溶液至 pH=7,此时混合溶液中两溶质的物质的量比n(CH3COOH):n(CH3COONa)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年10月17日,我国神舟11号飞船发射在即,长征三号丙型运载火箭开始加注燃料.长征三号丙型火箭第一级和第二级采用偏二甲肼(UDMH)和N2O4为动力源,反应方程式为:(CH3)2N2H2+2N2O4=2CO2+4H2O+3N2 , 关于该反应的说法中正确的是( )
A.该反应不是氧化还原反应
B.氮气只是氧化产物
C.N2O4是还原剂
D.N2O4是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80℃时,2 L密闭容器中充入0.40 mol N2O4,发生如下反应:N2O4(g)![]() 2NO2(g)。一段时间后达到平衡,测得数据如下:
2NO2(g)。一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/( mol·L1) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
请回答:
(1)20 s内,v(NO2) =_________mol/(L·s) 1。
(2)升高温度时,c(NO2)增大,则正反应是______(选填“放热”或“吸热”)反应。
(3)该温度下反应的化学平衡常数数值为______。
(4)该条件下N2O4的平衡转化率是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原料药合成路线如下:
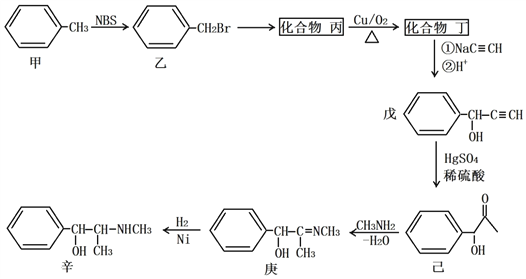
(1)甲→乙的反应类型为_______________;乙→丙的反应条件为__________________。
(2)丁的名称为_______________;戊的分子式为__________________。
(3)丁发生银镜反应的化学方程式为___________________________________________;己→庚的化学方程式为___________________________________________。
(4)化合物己的芳香族同分异构体有多种,A和B是其中的两类,它们的结构和性质如下:
①已知A遇FeC13溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则A的结构简式可能为________________或________________。
②已知B中含有甲基,能发生水解反应,苯环上只有一个取代基,则B的结构有___种。
(5)丁烯酮(![]() )可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC≡CH)为原料(无机试剂任选),设计制备丁烯酮的合成路线:___________________。
)可用作聚合反应单体制取阴离子树脂,还可用作烷基化剂和合成甾族化合物及维生素A的中间体。请以乙烯和乙炔钠(NaC≡CH)为原料(无机试剂任选),设计制备丁烯酮的合成路线:___________________。
合成路线流程图示例如:A ![]() B……
B……![]() 目标产物。
目标产物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
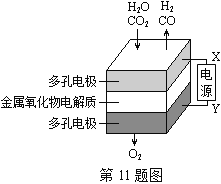
A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为________L,NO2的体积为________L。
(2)待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中Cu2+全部转化成沉淀,则原硝酸溶液的浓度为__________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com