
| 0.224L |
| 22.4L/mol |


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
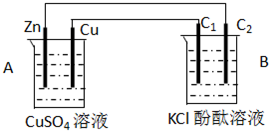
科目:高中化学 来源:不详 题型:单选题
| A.a为正极,b为负极 | B.a极上有氢气放出 |
| C.b极上发生氧化反应 | D.b极附近溶液显碱性 |
查看答案和解析>>
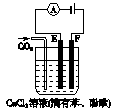
科目:高中化学 来源:不详 题型:单选题
| A.X为负极,Y为正极 |
| B.Y极表面变红,质量增加 |
| C.阳极发生氧化反应:2Cl--2e-═Cl2↑ |
| D.电解时,溶液中电子的流向是:X→Y |
查看答案和解析>>
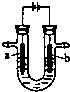
科目:高中化学 来源:不详 题型:单选题
| A.NaOH溶液 | B.稀硫酸 | C.CuSO4溶液 | D.KNO3溶液 |
查看答案和解析>>
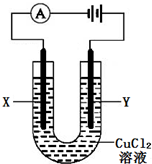
科目:高中化学 来源:不详 题型:多选题
| A.a电极材料为石墨,电极反应式为2H++2e-=H2↑ |
| B.液体c为苯或乙醇,作用是防止空气中氧气氧化Fe(OH)2 |
| C.在加入液体c之前,需要对电解液d进行加热处理 |
| D.电解液d若是NaOH溶液,则白色沉淀在电极附近生成;电解液d若是NaCl溶液,则白色沉淀在两电极之间的溶液中生成 |
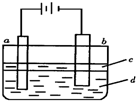
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com