
【题目】已知在100℃的温度下(本题涉及的溶液温度均为100℃),水的离子积KW=1×10﹣12 . 下列说法正确的是( )
A.0.001 mol/L的NaOH溶液pH=9
B.0.1 mol/L的H2SO4溶液pH=1
C.0.005 mol/L的H2SO4溶液与0.01 mol/L的NaOH溶液等体积混合,混合溶液pH为6,溶液显酸性
D.完全中和pH=3的H2SO4溶液50 mL,需要pH=11的NaOH溶液50 mL
【答案】A
【解析】解:100℃的温度下,水的离子积KW=1×10﹣12,所以该温度下的中性溶液中pH=6,
A.0.001mol/L的氢氧化钠溶液,氢氧根离子浓度为0.001mol/L,则C(H+)= ![]() =10﹣9 mol/L,pH=9,故A正确;
=10﹣9 mol/L,pH=9,故A正确;
B、0.1 mol/L的H2SO4溶液氢离子浓度为0.2mol/L,故B错误;
C.0.005 molL﹣1的硫酸与0.01 molL﹣1的氢氧化钠溶液等体积时,n(H+)=n(OH﹣),所以硫酸和氢氧化钠恰好反应,溶液呈中性,pH为6,故C错误;
D.pH=3的硫酸中,C(H+)=10﹣3 mol/L,pH=11的NaOH溶液中C(OH﹣)=0.1mol/L,中和pH=3的硫酸溶液50 mL,需要pH=11的NaOH溶液0.5mL,故D错误;
故选A.
100℃的温度下,水的离子积KW=1×10﹣12,所以该温度下的中性溶液中pH=6,pH小于6的为酸性溶液,大于6的为碱性溶液,pH=﹣lgc(H+),强酸和强碱反应的混合溶液呈中性时,氢离子和氢氧根离子的物质的量相等,注意碱性溶液中氢氧根离子浓度的计算方法.


科目:高中化学 来源: 题型:
【题目】温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: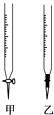
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
(1)操作F中应该选择图中 滴定管(填标号)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 。
(3)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | |||
① | 20 | 1.02 | 21.03 | |
② | 20 | 2.00 | 25.00 | |
③ | 20 | 0.60 | 20.59 | |
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家为实现“低碳”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是 . (填编号)
A.H2O(g)和CH3OH(g)的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.v (H2)=3v (H2O)
E.容器中混合气体的密度保持不
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应.反应相同时间后,测得甲醇的体积分数Φ(CH3OH)与反应温度T的关系如图1,则上述CO2转化为甲醇的反应的平衡常数表达式为 , 升高温度该平衡常数(填“增大”、“减小”、“不变”) 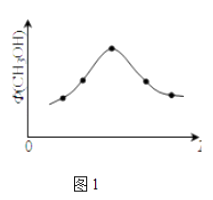
(3)300℃时,将CO2与H2按1:3的体积比充入某密闭容器中,CO2的平衡转化率(α)与体系总压强(P)的关系如图2所示.回答下列问题: 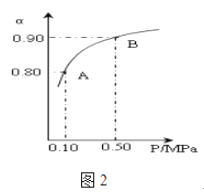
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是 . (填编号)
A.CO2的浓度减小
B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1:3
D.H2的体积分数减小
②A点平衡混合气体的平均摩尔质量为(保留一位小数).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质.下列说法正确的是( ) 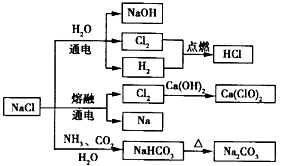
A.25℃,NaHCO3在水中的溶解度比Na2CO3的大
B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.如图所示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京提出2008年“绿色奥运”的口号,为改善北京空气质量,将冬季燃烧煤取暖改用天然气做燃料.主要是为了( )
A.减少氮氧化物的排放
B.降低对臭氧层的破坏
C.减少二氧化碳的排放
D.防止温室效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于自然界中氮循环(如图)的说法不正确的是( )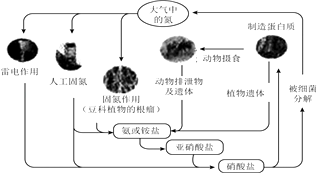
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参加了氮循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学内容,完成下列问题:
(1)过氧化钠固体的颜色是______________。
(2)写出磁性氧化铁的化学式_____________,小苏打的化学式____________。
(3)写出实验室加热NH4Cl和Ca(OH)2的混合物制取NH3的化学方程式:_______。
(4)若要提取饱和碘水中的碘,所用的萃取剂可以是___________(填序号)。
① 四氯化碳 ② 酒精 ③ 淀粉溶液
(5)红热的木炭与浓硝酸反应的化学方程式为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O,该反应中氧化剂和还原剂的物质的量之比为_________;如果产生标准状况下22.4 L CO2,则转移的电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法,不正确的是( ) 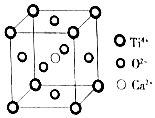
( Ti4+位于顶点上,O2﹣位于面心上,Ca2+位于中心)
A.该晶体的化学式为CaTiO3
B.该晶体中每个Ti4+和8个O2﹣相紧邻
C.一个CO2晶胞中平均含有4个CO2分子
D.金属晶体的熔点可能比分子晶体的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是
A.配制一定物质的量浓度的硫酸溶液时,用量筒量取一定体积的浓硫酸倒入烧杯后,再用蒸馏水洗涤量筒2~3次,并将洗涤液一并倒入烧杯中稀释
B.玻璃导管蘸水后,边旋转边向橡皮管中插入
C.用胶头滴管向试管中加入液体时,为防止滴在试管外面,应将滴管尖嘴处伸入试管口中
D.称量氢氧化钠固体的质量时,将称量物放在纸片上,并置于托盘天平的左盘,砝码放在托盘天平的右盘。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com