
CO、CH4均为常见的可燃性气体.120℃、101kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强.
(1)若混合气体与氧气恰好完全反应,产生bmL二氧化碳,混合气体中一氧化碳和甲烷的物质的量之比为: 2:1 ;混合物中甲烷的质量分数为: 33% .
(2)若燃烧后气体体积缩小了a/4mL,则a与b关系的数学表示式是 b≥a .
| 化学方程式的有关计算.. | |
| 专题: | 计算题. |
| 分析: | (1)根据CO、CH4的体积之和、消耗的氧气列方程计算二者体积,据此解答. (2)燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),燃烧后体积变化由CO燃烧导致,根据差量法计算CO的体积,进而计算甲烷的体积,由于完全燃烧,故0.5V(CO)+2V(CH4)≤b,据此解答. |
| 解答: | 解:(1)燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),根据碳原子守恒可知,V(CO+CH4)=V(CO2),故a=b, 则:V(CO)+V(CH4)=a,0.5V(CO)+2V(CH4)=a,解得V(CO)=
故答案为:2:1;33%; (2)燃烧发生反应:2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),燃烧后体积变化由CO燃烧导致,则: 2CO+O2=2CO2 体积减少△V 2 1 V(CO) mL 故V(CO)=0.5amL,V(CH4)=0.5amL, 由于完全燃烧,故0.5V(CO)+2V(CH4)≤b,即0.5a×0.5+2×0.5a≤b,故b≥a, 故答案为:b≥a. |
| 点评: | 本题考查混合物计算等,难度中等,(2)中注意利用差量法的计算. |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
下列关于氯及其化合物的性质的说法,正确的是( )
A. 液氯、氯水、次氯酸都具有漂白性
B. 氯气可用向下排空气法收集
C. 氯气能与大多数金属化合,且一般将变价金属氧化至最高价
D. Cl-检验一般先加酸酸化(硝酸或盐酸),再加硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
解释下列物质性质的变化规律与物质结构间的因果关系时,与化学键强弱无关的变化规律是
A.HF、HCI、HBr、HI的热稳定性依次减弱
B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.F2、C12、Br2、I2的熔、沸点逐渐升高
D.Li、Na、K、Rb 的熔点逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组物质不能用一种试剂通过化学反应区别的是( )
|
| A. | MnO2CuO FeO | B. | Na2CO3CaCO3 K2CO3 |
|
| C. | AgNO3KNO3 Na2CO3 | D. | (NH4)2SO4 K2SO4 NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有大量的下列离子:Mg2+、NO3﹣、K+和M离子,经测定Mg2+、NO3﹣、K+离子的物质的量之比为2:4:1,则M离子可能是下列中的( )
|
| A. | Cl﹣ | B. | SO42﹣ | C. | OH﹣ | D. | Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.金属腐蚀就是金属失去电子被还原的过程
B.将水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
C.合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强
D.铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e- = Fe3+,继而形成铁锈
查看答案和解析>>
科目:高中化学 来源: 题型:
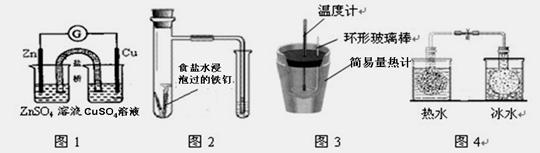
对下列实验的描述正确的是
A.图1所示的实验:根据电流计(G)中指针是否偏转即可比较Zn、Cu金属活泼性
B.图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图3所示的实验:根据温度计读数的变化测定稀硫酸和NaOH溶液反应的反应热
D.图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g) N2O4(g)是吸热反应
N2O4(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.室温时1 L 0.01 mol·L-1的硫酸氢钠溶液的pH为____________,在其中滴入等体积的0.01 mol·L-1的Ba(OH)2溶液后,加水稀释到10 L,所发生反应的离子方程式为_____________________________________,pH为________。
Ⅱ.某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
 (1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)判断滴定终点的现象是: 。
(3)如下图是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:请计算待测盐酸溶液的浓度: mol/L。
| 滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.40 | 20.40 |
| 第二次 | 20.00 | 2.00 | 24.10 |
| 第三次 | 20.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将反应4(NH4)2SO4→N2↑+6NH3↑+3SO2↑+SO3↑+7H2O的产物气体通入BaCl2溶液,下列判断正确的是
A.无沉淀生成 B.得到的沉淀是BaSO4和BaSO3组成的混合物
C.得到的沉淀是纯净物 D.肯定没有BaSO3生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com