
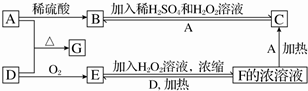
分析 由A$\stackrel{稀硫酸}{→}$B$\stackrel{稀硫酸、H_{2}O_{2}}{→}$C,可知A为变价金属,可推知A为Fe,B为FeSO4,C为Fe2(SO4)3,由F→C可推知F为H2SO4,进而推出D为S,E为SO2,G为FeS,故F+D→E为2H2SO4(浓)+S═3SO2↑+2H2O,据此解答.
解答 解:由A$\stackrel{稀硫酸}{→}$B$\stackrel{稀硫酸、H_{2}O_{2}}{→}$C,可知A为变价金属,可推知A为Fe,B为FeSO4,C为Fe2(SO4)3,由F→C可推知F为H2SO4,进而推出D为S,E为SO2,G为FeS,故F+D→E为2H2SO4(浓)+S═3SO2↑+2H2O.
(1)由上述分析可知,A为Fe,G为FeS,故答案为:Fe;FeS;
(2)浓硫酸与Fe反应过程中,硫酸体现强氧化性、酸性,
A.浓硫酸只体现强氧化性,无酸性体现,故A错误;
B.硫酸体现弱氧化性,是氢离子的氧化性,无强氧化性,故B错误;
C.反应生成硫酸铜和二氧化硫,浓硫酸体现强氧化性、酸性,故C正确;
D.无化合价变化,无强氧化性体现,硫酸体现酸性,故D错误;
故答案为:C;
(3)E+H2O2→F的化学方程式为:SO2+H2O2═H2SO4,
故答案为:SO2+H2O2═H2SO4;
(4)F+D→E反应方程式为:2H2SO4(浓)+S═3SO2↑+2H2O,转移电子数为6.02×1023,即转移电子为1mol,则消耗S为$\frac{1mol}{4}$=0.25mol,则消耗硫的质量为0.25mol×32g/mol=8g,
故答案为:8g.
点评 本题考查无机物的推断,涉及Fe、S元素单质及其化合物的性质,根据“金属A与硫酸反应生成B,B能氧化生成C”推断B为变价金属性,需要学生具备一定的推理能力与扎实的基础知识.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用焰色反应鉴別Na2CO3溶液和K2CO3溶液 | |
| B. | 用分液漏斗分离食醋中的乙酸与水 | |
| C. | 用丁达尔现象检验NaCl溶液中是否含有淀粉胶体 | |
| D. | 用NaOH溶液除去Cl2中混有的少量HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-=Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH- | |
| C. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ | |
| D. | 锌铜原电池中,锌做负极,发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①③④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊溶液显蓝色的溶液:Na+、Fe3+、HCO3-、NO3- | |
| B. | 0.1 mol•L-1 AgNO3溶液:H+、K+、SO42-、I- | |
| C. | 0.1 mol•L-1 AlCl3溶液:Mg2+、K+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 NaAlO2溶液:H+、Na+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com