
分析 在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用.根据氧化还原反应中电子转移守恒计算被水还原的BrF3的物质的量.
解答 解:在反应3BrF3+5H2O=HBrO3+Br2+9HF+O2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为0价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用.
由方程式可知若有1mol溴分子生成,则有2mol水被氧化,失去电子的物质的量为2mol×(2-0)=4mol,
令被水还原的BrF3的物质的量为xmol,根据电子转移守恒,则4mol=xmol×(3-0),
x=$\frac{4}{3}$mol,
故答案为:Br、O;$\frac{4}{3}$.
点评 本题考查氧化还原反应的计算、氧化还原反应基本概念,为高频考点,侧重于学生的分析、计算能力的考查,难度中等,关键根据化合价判断氧化剂、还原剂,利用电子转移守恒、元素守恒计算.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
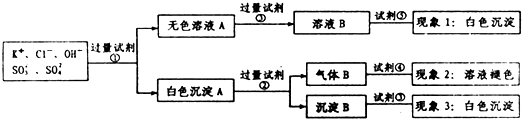
| A. | 试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl | |
| B. | 现象3中白色沉淀是BaSO4 | |
| C. | 试剂②是盐酸,试剂③是硝酸 | |
| D. | 产生现象2的离子方程式是:Br2+2H2O+SO2═4H++2Br-+SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
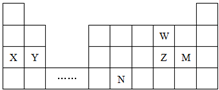
| A. | 原子半径:X>Y>W | |
| B. | 单质的氧化性:W>Z | |
| C. | 溴与元素M同主族,气态氢化物的稳定性比M的强 | |
| D. | 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
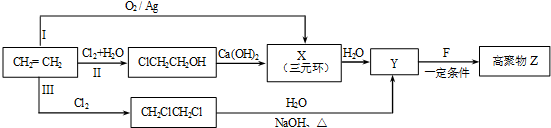
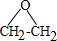 .
.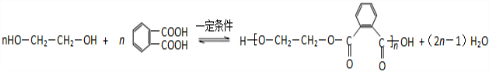 .
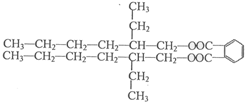
.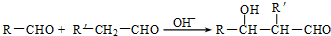 (R、R'代表烃基或氢原子).合成P的路线如下图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.
(R、R'代表烃基或氢原子).合成P的路线如下图所示.D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3.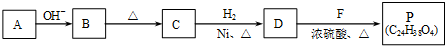
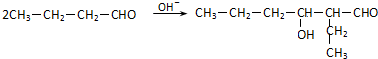 .
.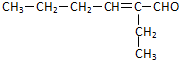 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4+H2O2+3H2SO4=K2SO4+2MnSO4+4H2O+3O2↑ | |
| B. | 2KMnO4+3H2O2+3H2SO4=K2SO4+2MnSO4+6H2O+4O2↑ | |
| C. | 2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑ | |
| D. | 2KMnO4+7H2O2+3H2SO4=K2SO4+2MnSO4+10H2O+6O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
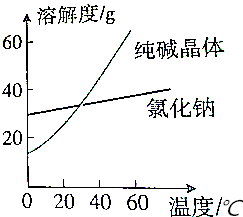
| A. | 蒸馏法 | B. | 苹取法 | C. | 结晶法 | D. | 分液法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
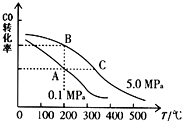 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
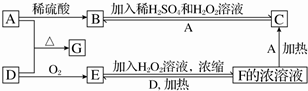
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com