
【题目】常温下,在水溶液中发生如下反应:①16H++10C-+2XO![]() ===2X2++5C2+8H2O ②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列说法错误的是
===2X2++5C2+8H2O ②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列说法错误的是
A. 反应C2+2A2+===2A3++2C-可以进行 B. 反应③是置换反应
C. 氧化性由强到弱的顺序是XO![]() >C2>B2>A3+ D. 还原性由强到弱的顺序是C->A2+>B->X2+
>C2>B2>A3+ D. 还原性由强到弱的顺序是C->A2+>B->X2+
【答案】D
【解析】
A.还原性由②知道A2+![]() -,由③知道B-
-,由③知道B-![]() -,所以还原性A2+
-,所以还原性A2+![]() -;氧化性由②知道B2
-;氧化性由②知道B2![]() A3+,由③知道C2
A3+,由③知道C2![]() B2,所以氧化性C2
B2,所以氧化性C2![]() A3+,依据符合氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性反应就能进行的规律,反应
A3+,依据符合氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性反应就能进行的规律,反应![]() 可以进行,故A正确;
可以进行,故A正确;
B.反应③是单质与化合物反应产生新的单质和新的化合物,因此该反应的基本类型是置换反应,故B正确;
C.氧化还原反应中氧化剂的氧化性大于氧化产物,由①![]() ,由②
,由②![]() ,由③
,由③![]() 因此氧化性由强到弱的顺序是
因此氧化性由强到弱的顺序是![]() ,故C正确;
,故C正确;
D.还原剂的还原性大于还原产物,根据①可知还原性![]() ;根据②可知还原性:
;根据②可知还原性:![]() ;根据③可知还原性:
;根据③可知还原性:![]() ,所以还原性由强到弱的顺序是
,所以还原性由强到弱的顺序是![]() ;所以选项D错误。
;所以选项D错误。
本题答案为D。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】下列有关焰色反应实验操作注意事项的说法中正确的是( )
①钾的火焰颜色要透过蓝色钴玻璃观察
②先将铂丝灼烧到与原来火焰的颜色相同,再蘸取被检验的物质
③每次实验后,要将铂丝用盐酸洗净
④钡的焰色反应为黄绿色
⑤没有铂丝时,也可以用玻璃棒代替
A.仅有③不正确B.仅有④不正确C.仅有⑤不正确D.全对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,下列有关四个曲线图的说法正确的是

A. 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图②可以表示相同pH的醋酸和盐酸分别加水稀释时溶液的pH随溶液体积的变化
C. 图③可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时的pH变化
D. 由图④可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
Ⅰ.(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)取一定量氯化亚铁固体,配制成0.1 mol/L 的溶液。检验亚铁离子是否被氧化的方法:______________________________________________。
Ⅱ.工业上用赤铁矿(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO、SiO2等)制备绿矾FeSO4·7H2O的流程如下:
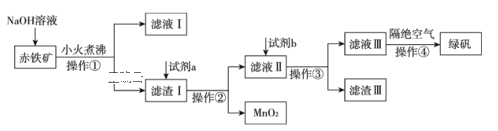
(1)氢氧化钠溶液加入赤铁矿中发生反应的离子方程式为____________;_________________。
(2)向滤渣Ⅰ中加入过量的试剂a为___________,过量的试剂b投入到滤液Ⅱ发生的所有反应的离子方程式为______________;_________________;________________。
(3)实验室中操作①②③的名称为_________________________。
(4)操作④隔绝空气的目的是_______________________________________________。
Ⅲ. 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是________(填氧化剂、还原剂),与CO2反应的化学反应方程式_________________________。
(2)湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:___________________________________________________________。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(8分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是________(填装置序号)。
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其反应的化学方程式:__________________;
与实验Ⅲ相比,实验Ⅳ的优点是__________(填选项序号)。
A.Ⅳ比Ⅲ复杂 |
B.Ⅳ比Ⅲ安全 |
C.Ⅳ比Ⅲ操作简便 |
D.Ⅳ可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe3++2I-![]() 2Fe2++I2,用KI溶液和FeCl3溶液进行如下实验。下列说法不正确的是
2Fe2++I2,用KI溶液和FeCl3溶液进行如下实验。下列说法不正确的是

A. 实验i中现象说明有Fe2+生成
B. 实验ⅱ中现象说明反应后溶液中含有Fe3+
C. 实验ⅲ水溶液中c(Fe2+)大于i中c(Fe2+)
D. 实验ⅲ中再加入4滴0.1mol·L-1FeCl2溶液,振荡静置,CCl4层溶液颜色无变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入 溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被_________(填“氧化”或“还原”);向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应为_____________________。
溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被_________(填“氧化”或“还原”);向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应为_____________________。
(2)装置2中的石墨是_______极(填“正”或“负”),该装置发生的总反应的离子方程式为_______。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的![]() 溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为_____极;甲烧杯中铁电极的电极反应为_____;
结合平衡移动原理,说明甲烧杯中石墨电极附近溶液变红的原因_____。
②乙烧杯中电解反应的离子方程式为_____。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中,发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
CO(g)+H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
T/℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
试回答下列问题:
(1)该反应的平衡常数表达式为K=___________。
(2)上述反应为_______(填“放热”成“吸热”反应,升高温度,平衡向______(填“正反应”或“逆反应”)方向移动。
(3)800℃时,向恒容密用容器中加入混合物,起始浓度分别为c(CO)=0.01mol/L、c(H2O)=0.03mol/L、c(CO2)=0.1mol/L、c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率____(填“>”"<"或"=")生成速率。
(4)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(g)发生上述反应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=_____mol/(L·min)
②该温度下反应的平衡常数K=________。
(5)可逆反应: CO2(g)+H2(g)![]() CO(g)+H2O(g)的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是_________。
CO(g)+H2O(g)的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是_________。

(6)生产水煤气的过程如下:
①C(s)+CO2(g)![]() 2CO(g) △H1
2CO(g) △H1
②C(s)+H2O(g)![]() CO(g)+H2(g) △H2
CO(g)+H2(g) △H2
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com