
【题目】在一恒容密闭容器中,发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
CO(g)+H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
T/℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
试回答下列问题:
(1)该反应的平衡常数表达式为K=___________。
(2)上述反应为_______(填“放热”成“吸热”反应,升高温度,平衡向______(填“正反应”或“逆反应”)方向移动。
(3)800℃时,向恒容密用容器中加入混合物,起始浓度分别为c(CO)=0.01mol/L、c(H2O)=0.03mol/L、c(CO2)=0.1mol/L、c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率____(填“>”"<"或"=")生成速率。
(4)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(g)发生上述反应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=_____mol/(L·min)
②该温度下反应的平衡常数K=________。
(5)可逆反应: CO2(g)+H2(g)![]() CO(g)+H2O(g)的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是_________。
CO(g)+H2O(g)的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是_________。

(6)生产水煤气的过程如下:
①C(s)+CO2(g)![]() 2CO(g) △H1
2CO(g) △H1
②C(s)+H2O(g)![]() CO(g)+H2(g) △H2
CO(g)+H2(g) △H2
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
【答案】 ![]() 吸热 正反应 < 0.15 1.8 升高温度 △H1-△H2
吸热 正反应 < 0.15 1.8 升高温度 △H1-△H2
【解析】(1)平衡常数表达式为生成物浓度的幂之积与反应物浓度的幂之积的比值,该反应的平衡常数表达式为K=![]() ;正确答案:
;正确答案:![]() 。
。
(2)根据图表信息可知,温度升高,K增大,该反应正反应为吸热反应;升高温度,平衡向正反应方向移动;正确答案:吸热;正反应 。
(3)根据图表信息可知800℃时,平衡常数为0.9;该反应的浓度商为Q=0.01×0.03/0.1×0.05=0.06<0.9,反应正向进行,H2O的消耗速率小于水的生成速率;正确答案:<。
(4)容器的体积为2L;根据反应方程式
CO2(g) + H2(g) ![]() CO(g)+ H2O(g);
CO(g)+ H2O(g);
起始量 2 4 0 0
变化量 2×75% 2×75% 2×75% 2×75%
平衡量 0.5 2.5 1.5 1.5
①v(H2O)=1.5÷2÷5= 0.15 mol/(L·min);正确答案:0.15。
②平衡后各物质浓度分别为c(CO2)=0.5/2=0.25 mol/L、c(H2)=2.5/2=1.25 mol/L、 c(CO)= c(H2O)=1.5/2=0.75 mol/L;该温度下反应的平衡常数K=0.752/0.25×1.25=1.8;
正确答案:1.8。
(5)根据图像分析,t2时v(正)、v(逆)都增大,且v(正)增加的快,平衡右移;该反应是一个反应前后体积不变的、吸热的可逆反应,增大压强,缩小体积,速率均加快,但是平衡不动,不合题意;升高温度,速率均加快,平衡右移,v(正)增加的快,符合题意;正确答案:升高温度。
(6)根据盖斯定律:用反应①-反应②,整理得CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=△H1-△H2;正确答案:△H1-△H2。
CO(g)+H2O(g) △H=△H1-△H2;正确答案:△H1-△H2。


科目:高中化学 来源: 题型:
【题目】常温下,在水溶液中发生如下反应:①16H++10C-+2XO![]() ===2X2++5C2+8H2O ②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列说法错误的是
===2X2++5C2+8H2O ②2A2++B2===2A3++2B-;③2B-+C2===B2+2C-。下列说法错误的是
A. 反应C2+2A2+===2A3++2C-可以进行 B. 反应③是置换反应
C. 氧化性由强到弱的顺序是XO![]() >C2>B2>A3+ D. 还原性由强到弱的顺序是C->A2+>B->X2+
>C2>B2>A3+ D. 还原性由强到弱的顺序是C->A2+>B->X2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下(SiO2 不溶于盐酸):
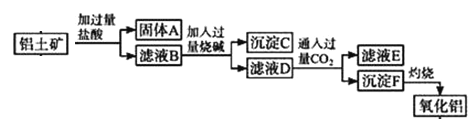
请回答下列问题:
(1)沉淀C的主要成分是______________(写化学式).
(2)滤液D中通入过量CO2的离子方程式为___________.
(3)写出灼烧沉淀F的化学反应化学方程式______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水只作氧化剂的氧化还原反应为: ( )
A.Cl2+H2O=HCl+HClOB.2Na2O2+2H2O=4NaOH+O2↑
C.H2O+CaO=Ca(OH)2D.2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图所示。则下列叙述正确的是

A. 有机物A的分子式为C10H11O4Cl
B. 有机物A能与溴水发生加成反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物C能治疗血管疾病,它在人体内能释放出一种“信使分子”D。已知C的相对分子质量为227,由C、H、O、N四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。

(1)C的分子式为________。D是双原子分子,相对分子质量为30,则D的分子式为______。
(2)药物C可由油脂A经如图途径得到。反应②的化学方程式为_____________________。
(3)0.1molB与足量的金属钠反应,消耗____g金属钠。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com