
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下(SiO2 不溶于盐酸):
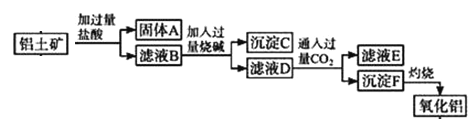
请回答下列问题:
(1)沉淀C的主要成分是______________(写化学式).
(2)滤液D中通入过量CO2的离子方程式为___________.
(3)写出灼烧沉淀F的化学反应化学方程式______________.
【答案】Mg(OH)2 和Fe(OH)3 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-、OH-+CO2=HCO3- 2Al(OH)3![]() Al2O3+ 3H2O
Al2O3+ 3H2O
【解析】
铝土矿中的Al2O3、Fe2O3、MgO都可与盐酸反应而溶解,只有SiO2不溶于盐酸,故滤液B中含有AlCl3、FeCl3、MgCl2,HCl等。向滤液B中加入过量烧碱发生反应有中和反应、沉淀反应,可确定沉淀C的主要成分。滤液D中含有NaAlO2、NaCl、NaOH等,向滤液D中通入过量的CO2发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,OH-+CO2=HCO3-,滤液E是NaHCO3和NaCl溶液,沉淀F是Al(OH)3,灼烧Al(OH)3发生分解反应。由此分析。
根据铝土矿中的成分,向铝土矿中加过量的盐酸发生的反应有Al2O3+6H+=2Al3++3H2O,Fe2O3+6H+=2Fe3++3H2O,MgO+2H+=Mg2++H2O。SiO2不溶于盐酸,所以固体A是SiO2,滤液B中含有AlCl3、FeCl3、MgCl2,HCl等,向滤液B中加入过量烧碱发生反应有H++OH-=H2O,Al3++4OH-=AlO2-+2H2O,Fe3++3OH-=Fe(OH)3↓,Mg2++2OH-=Mg(OH)2↓,故沉淀C的主要成分是Fe(OH)3 、Mg(OH)2,滤液D中含有NaAlO2、NaCl、NaOH。向滤液D中通入过量的CO2发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,OH-+CO2=HCO3-,滤液E是NaHCO3和NaCl溶液,沉淀F是Al(OH)3,灼烧Al(OH)3发生分解反应:2Al(OH)3![]() Al2O3+3H2O,最后得到氧化铝。
Al2O3+3H2O,最后得到氧化铝。
(1)溶液C的主要成分是Fe(OH)3和Mg(OH)2。
(2)滤液D中通入过量CO2的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 、OH-+CO2=HCO3-。
(3)灼烧Al(OH)3沉淀发生分解反应,其化学反应方程式为:2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】化学中常借助曲线图来表示某种变化过程,下列有关四个曲线图的说法正确的是

A. 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图②可以表示相同pH的醋酸和盐酸分别加水稀释时溶液的pH随溶液体积的变化
C. 图③可以表示向一定量的氢氧化钠溶液中滴加一定浓度的稀硫酸时的pH变化
D. 由图④可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入 溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被_________(填“氧化”或“还原”);向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应为_____________________。
溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被_________(填“氧化”或“还原”);向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨棒附近的溶液变红,该电极反应为_____________________。
(2)装置2中的石墨是_______极(填“正”或“负”),该装置发生的总反应的离子方程式为_______。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的![]() 溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为_____极;甲烧杯中铁电极的电极反应为_____;
结合平衡移动原理,说明甲烧杯中石墨电极附近溶液变红的原因_____。
②乙烧杯中电解反应的离子方程式为_____。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化碳(![]() )排放量减少8%,氮氧化物(
)排放量减少8%,氮氧化物(![]() )排放量减少10%。目前,消除大气污染有多种方法,利用钠碱循环法可脱除烟气中的
)排放量减少10%。目前,消除大气污染有多种方法,利用钠碱循环法可脱除烟气中的![]() 。
。
(1)在钠碱循环法中, ![]() 溶液作为吸收液,可由NaOH溶液吸收
溶液作为吸收液,可由NaOH溶液吸收![]() 制得,该反应的离子方程式是_______________________。
制得,该反应的离子方程式是_______________________。
(2)吸收液吸收![]() 的过程中,pH随
的过程中,pH随![]() 变化关系如下表:
变化关系如下表:
| 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断![]() 溶液显______________性,用化学平衡原理解释:_____________。
溶液显______________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):___________。
a. ![]()
b. ![]()
c. ![]()
(3)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:

①![]() 在阳极放电的电极反应式是________________。
在阳极放电的电极反应式是________________。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:
_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)将切开的小块钠投入到FeCl3溶液,现象是_________;反应的方程式为_____________。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为_____________________.
(3)分别将0.2mol的钠、镁、铝分别投入100ml 1mol·L-1的盐酸溶液中,三者产生的氢气在相同条件下的体积比为____________________。
(4)用双线桥标出电子转移的方向和数目: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O________
MnCl2+Cl2↑+2H2O________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象的预测不正确或实验设计不能达到实验目的的是

A. 实验I:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应
B. 实验II:倒转振荡后正立静置,下层液体为紫红色
C. 实验III:比较NaHCO3和Na2CO3的热稳定性
D. 实验IV:制备Fe(OH)2并观察其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容密闭容器中,发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
CO(g)+H2O(g) △H。其平衡常数(K)和温度(T)的关系如下表:
T/℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
试回答下列问题:
(1)该反应的平衡常数表达式为K=___________。
(2)上述反应为_______(填“放热”成“吸热”反应,升高温度,平衡向______(填“正反应”或“逆反应”)方向移动。
(3)800℃时,向恒容密用容器中加入混合物,起始浓度分别为c(CO)=0.01mol/L、c(H2O)=0.03mol/L、c(CO2)=0.1mol/L、c(H2)=0.05mol/L,则反应开始时,H2O的消耗速率____(填“>”"<"或"=")生成速率。
(4)某温度下,在体积为2L的恒容密闭容器中通入2molCO2(g)和4molH2(g)发生上述反应,5min时反应达到平衡,测得CO2(g)的转化率是75%。
①v(H2O)=_____mol/(L·min)
②该温度下反应的平衡常数K=________。
(5)可逆反应: CO2(g)+H2(g)![]() CO(g)+H2O(g)的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是_________。
CO(g)+H2O(g)的化学反应速率(v)与时间(t)的关系如图所示,在图中t2时只改变一个条件,则改变的条件是_________。

(6)生产水煤气的过程如下:
①C(s)+CO2(g)![]() 2CO(g) △H1
2CO(g) △H1
②C(s)+H2O(g)![]() CO(g)+H2(g) △H2
CO(g)+H2(g) △H2
反应CO2(g)+H2(g)![]() CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
CO(g)+H2O(g) △H=_______(用含△H1、△H2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的物质绝大多数以混合物的形式存在,为了便于研究和利用,常需对混合物进行分离和提纯。下列A、B、C、D是中学常见的混合物分离或提纯的装置。

I.请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D 填入适当的空格中。
(1)碳酸钙悬浊液中分离出碳酸钙__________________;
(2)氯化钠溶液中分离出氯化钠____________________;
(3)分离植物油和水____________________;
(4)分离酒精和水____________________;
(5)氯化钠溶液中分离出水____________________。
II.碘水中提取碘单质的方法如下:
(1)萃取分液
①下列可作为碘水中提取碘单质萃取剂的有__________
A.酒精 B.苯
②分液漏斗在使用前必须先________________;
③查资料得知:ρ(H2O)>ρ(苯)>ρ(酒精),若用①中所选萃取剂萃取碘水中的碘单质,分液时,水层应由分液漏斗的_______端口放出,有机层应由分液漏斗的________端口放出(此问填“上”或者“下”) ;
(2)蒸馏
①冷凝装置中冷凝水应该_______口进(填“上”或“下”)
②已知碘和四氯化碳的熔沸点数据如下表
熔点 | 沸点 | |
碘 | 113.7℃ | 184.3℃ |
四氯化碳 | -22.6℃ | 76.8℃ |
若用蒸馏法分离碘和四氯化碳的混合物,锥形瓶中先收集到的物质的名称是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com