
【题目】按要求填空:
(1)将切开的小块钠投入到FeCl3溶液,现象是_________;反应的方程式为_____________。
(2)实验室常用还原性Fe粉与水蒸气反应的实验来研究Fe的还原性,则该反应的化学反应方程式为_____________________.
(3)分别将0.2mol的钠、镁、铝分别投入100ml 1mol·L-1的盐酸溶液中,三者产生的氢气在相同条件下的体积比为____________________。
(4)用双线桥标出电子转移的方向和数目: MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O________
MnCl2+Cl2↑+2H2O________
【答案】钠浮在水面上,熔化成小球,四处游动,发出嘶嘶响声,有红褐色沉淀生成 2Na+2H2O=2NaOH+H2↑,3NaOH+FeCl3=Fe(OH)3↓+3NaCl 3Fe+4H2O(g) ![]() Fe3O4+4H2 2:1:1
Fe3O4+4H2 2:1:1 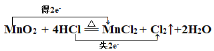
【解析】
(1) 将切开的小块钠投入到FeCl3溶液中,钠先与水剧烈地反应,生成的NaOH又与FeCl3反应生成Fe(OH)3红褐色沉淀,所以实验现象是钠浮在水面上,熔化成小球,四处游动,发出嘶嘶响声,有红褐色沉淀生成。其反应的化学方程式为2Na+2H2O=2NaOH+H2↑,3NaOH+FeCl3=Fe(OH)3↓+3NaCl。
(2)还原性铁粉能将水蒸气中氢元素置换生成H2,该反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2(g)。
Fe3O4+4H2(g)。
(3) 100ml 1mol·L-1的盐酸溶液中HCl物质的量=0.1L×1mol/L=0.1mol,将钠投入到盐酸中钠先与HCl反应,过量的钠继续与水反应直至耗尽2Na+2HCl=2NaCl+H2↑,2Na+2H2O=2NaOH+H2↑,由计量关系知2Na~H2↑,所以0.2mol钠生成0.1molH2。由反应式Mg+2HCl=MgCl2+H2↑知0.2mol镁过量, 0.1molHCl完全反应生成0.05molH2。由反应式2Al+6HCl=2AlCl3+3H2↑知0.2mol铝过量,0.1molHCl完全反应生成0.05molH2。因为相同条件下气体的体积比等于其物质的量之比,钠、镁、铝分别与盐酸反应产生氢气的体积比=0.1mol:0.05mol:0.05mol=2:1:1。
(4)分析反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O中元素化合价知:锰元素化合价由MnO2的+4价变化到MnCl2的+2价,化合价降低,每个锰原子得到2个电子;氯元素化合价由HCl的-1价变化到Cl2的0价,化合价升高,2个HCl失去2个电子。所以电子转移的方向和数目表示为:
MnCl2+Cl2↑+2H2O中元素化合价知:锰元素化合价由MnO2的+4价变化到MnCl2的+2价,化合价降低,每个锰原子得到2个电子;氯元素化合价由HCl的-1价变化到Cl2的0价,化合价升高,2个HCl失去2个电子。所以电子转移的方向和数目表示为: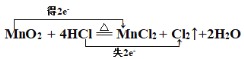 。
。


科目:高中化学 来源: 题型:
【题目】由烃A制备抗结肠炎药物H的一种合成路线如下 (部分反应略去试剂和条件):

回答下列问题:
(1)H的分子式是_____,A的化学名称是______。反应②的类型是_______。
(2)D的结构简式是___________。F中含有的官能团的名称是____________。
(3)E与足量NaOH溶液反应的化学方程式是______________。
(4)设计C→D和E→F两步反应的共同目的是_________。
(5)化合物X是H的同分异构体,X遇FeCl3溶液不发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为3∶2∶2,写出1种符合要求的X的结构简式_________________。
(6)已知![]() 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物![]() 的合成路线_______________________________(其他试剂任选)。
的合成路线_______________________________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F( )为一种高分子树脂,其合成路线如下:
)为一种高分子树脂,其合成路线如下:

已知:①A为苯甲醛的同系物,分子中无甲基,其相对分子质量为134;
②
请回答下列问题:
(1)X的化学名称是_________________。
(2)E生成F的反应类型为_________________。
(3)D的结构简式为_________________。
(4)由B生成C的化学方程式为_________________。
(5)芳香族化合物Y是D的同系物,Y的同分异构体能与饱和Na2CO3溶液反应放出气体,分子中只有1个侧链,核磁共振氢普显示有5种不同化学环境的氢,峰值面积比为6:2:2:1:1。写出两种符合要求的Y的结构简式___________、__________。
(6)写出以甲醛、丙醛和乙二醇为主要原料合成软质隐形眼镜高分子材料—聚甲基丙烯酸羟乙酯( )的合成路线(无机试剂自选):_________________。
)的合成路线(无机试剂自选):_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
作为一种重要的化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究着被列入国家863计划。催化剂常具有较强的选择性,即专一性。已知:
反应Ⅰ:![]()
![]()
![]() △H=
△H=![]()
反应Ⅱ:![]()
![]()
![]()
![]()
(1)在恒温恒容装置中充入一定量的![]() 和
和![]() ,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是___________________。
,在某催化剂的作用下进行反应I,则下列有关叙述中正确的是___________________。
A. 使用催化剂时,可降低该反应的活化能,加快其反应速率
B. 若测得容器内![]() 时,说明反应已达平衡
时,说明反应已达平衡
C. 当容器内![]() 时,说明反应已达平衡
时,说明反应已达平衡
D. 当测得容器内氧气浓度不再变化时,说明反应已达达平衡
(2)氨催化氧化时会发生上述两个竞争反应Ⅰ、Ⅱ。为分析某催化剂对该反应的选择性,1L密闭容器中充入1 mol ![]() 和2 mol
和2 mol ![]() ,测得有关物质的量关系如图
,测得有关物质的量关系如图
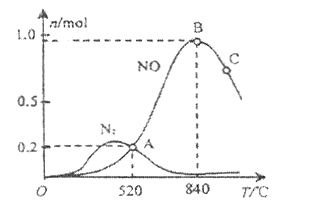
①该催化剂在高温时选择反应_______________(填“Ⅰ”或“Ⅱ”)。
②520℃时, ![]()
![]()
![]() 的平衡常数K表达式________。
的平衡常数K表达式________。
③有利于提高![]() 转化为
转化为![]() 的速率的措施有_________________。
的速率的措施有_________________。
A. 使用催化剂![]()
B. 将反应生成的![]() 及时移出
及时移出
C. 充入稀有气体
D. 投料比不变,增加反应物的浓度
E. 降低反应温度
(3)最近华南理工大提出利用电解法制![]() 并用产生的
并用产生的![]() 处理废氨水,装置如图
处理废氨水,装置如图
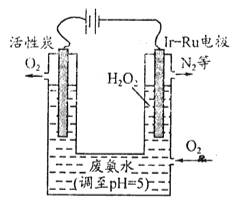
①为了不影响![]() 的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填>、=、<)。
的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中c(NH4+)_________c(NO3-)(填>、=、<)。
②Ir-Ru惰性电极有吸附![]() 作用,该电极上产生
作用,该电极上产生![]() 的反应为_________,生成的
的反应为_________,生成的![]() 与废液反应的离子方程式为_________________。
与废液反应的离子方程式为_________________。
③理论上电路中每转移3 mol电子,最多可以处理![]() 的物质的量为__________。
的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下(SiO2 不溶于盐酸):
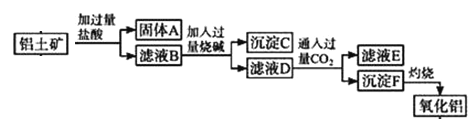
请回答下列问题:
(1)沉淀C的主要成分是______________(写化学式).
(2)滤液D中通入过量CO2的离子方程式为___________.
(3)写出灼烧沉淀F的化学反应化学方程式______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如图所示。则下列叙述正确的是

A. 有机物A的分子式为C10H11O4Cl
B. 有机物A能与溴水发生加成反应
C. 有机物A和浓硫酸混合加热,可以发生消去反应
D. 1molA和足量的NaOH溶液反应,最多可以消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com