
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]()
![]() N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
【答案】B
【解析】
提高该反应的NO的转化率只需让平衡正向移动,据此分析判断。
A.加催化剂能使反应速率加快,但平衡不移动,由于该反应为放热反应,升高温度,虽反应速率加快,但反应逆向进行,因此NO的转化率减小,A项错误;
B.加催化剂能使反应速率加快,但平衡不移动,由于该反应为气体体积缩小的反应,增大压强,反应速率加快,且平衡正向移动,因此加催化剂同时增大压强能提高该反应的速率和NO的转化率,B项正确;
C.由于该反应为放热反应,升高温度,虽反应速率加快,但反应逆向进行, NO的转化率减小,充入N2,增大了生成物的浓度,反应速率加快但平衡逆向移动,NO的转化率减小,C项错误;
D.由于该反应为放热反应,降低温度,反应速率减慢,反应正向进行,NO的转化率增大,由于该反应为气体体积缩小的反应,增大压强,反应速率加快,且平衡正向移动,NO的转化率增大,D项错误;
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境。某工厂对工业污泥中Cr(III)回收与再利用工艺流程如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
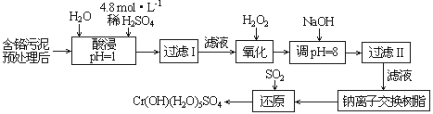
已知:常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH(开始沉淀的pH按金属阳离子浓度为1.0mol·L-1计算)和完全沉淀时溶液的pH,见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.5 | —— | —— | 4.7 | —— |
沉淀完全时的pH | 3.2 | 9.7 | 11.1 | 8 | 6.7 | 9(>9溶解) |
重铬酸根离子(Cr2O72-)在溶液中存在如下平衡:2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
(1)该工厂对工业污泥中Cr(+3价)回收与再利用工艺流程中,其中一步存在氢氧化铁的沉淀溶解平衡:Fe(OH)3(s)![]() Fe3+(aq)+3OH-(aq),其溶度积常数表达式为Ksp=__。
Fe3+(aq)+3OH-(aq),其溶度积常数表达式为Ksp=__。
(2)酸浸时,为了提高浸取率可采取的措施是__(至少答一点)。
(3)加入H2O2的作用是__。调节溶液的pH=8是为了除去__离子。
(4)钠离子交换树脂的原理为:Mn++nNaR→MRn+nNa+,被交换的的杂质离子是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗各类型高血压及心绞痛,其一种合成路线如下:

已知:①CH3COCH2R![]() CH3CH2CH2R
CH3CH2CH2R
② B- F苯环上均只有两个取代基
回答下列问题:
(1)A的化学名称是___,C中含氧官能团的名称是___
(2)E→F的反应类型是___,G的分子式为___。
(3)D的结构简式为___。
(4)反应B→C的化学方程式为___
(5)芳香族化合物W是G的同分异构体,W能发生水解反应,核磁共振氢谱有4组峰,峰面积之比为9:3:2:2,写出一种符合要求的W的结构简式:___.
(6)4一苄基苯酚(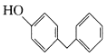 )是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
)是一种药物中间体,请设计以苯甲醇和苯酚为原料制备4-苄基苯酚的合成路线:______(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定含少量![]() 的小苏打固态样品中
的小苏打固态样品中![]() 的质量分数可采用以下四种方法。
的质量分数可采用以下四种方法。
方法一:
方法二:
方法三:
方法四:不使用化学试剂,使用实验室常用仅器。
按要求回答下列问题:
(1)方法一的操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要____________、____________;操作2的名称是____________该过程选择的指示剂是____________;该样品中![]() 的质量分数为____________[用如图数据填写含m、
的质量分数为____________[用如图数据填写含m、![]() )的表达式]。
)的表达式]。
(2)方法二中需要加入试剂A将![]() 离子转化为沉淀并称重。为提高实验的精度,在下列供选试剂中,试剂A的最佳选择为____________(填编号)。
离子转化为沉淀并称重。为提高实验的精度,在下列供选试剂中,试剂A的最佳选择为____________(填编号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
该方法中操作2的名称是____________;操作3的名称是____________;如何判断操作3目的己经达到:________________________。方法二中需要用到的定量仪器为____________。
(3)方法三中实验装置,如何检验装置气密性:________________________;装置中使用Y型管的优点是________________________;若实验中读数时量气管中液面位置如图所示,则测定结果将____________(填写“偏大”、“偏小”或“无影响”),如有影响应该如何调整?____________(若认为无影响可不回答此题)
(4)方法四的实验原理是____________(用化学方程式表示),实验中需测定的实验数据是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】数十亿年来,地球上的物质不断变化,大气的成分也发生了很大的变化。下表是目前空气和原始大气的主要成分:
目前空气的主要成分 |
|
原始大气的主要成分 |
|
用上表所涉及的分子填写下列空白:
(1)含有10个电子的分子有__________(填化学式,下同)。
(2)由极性键构成的非极性分子有________。
(3)与![]() 可直接形成配位键的分子有________
可直接形成配位键的分子有________
(4)不含孤电子对的分子(稀有气体除外)是______,它的立体构型为_______。
(5)极易溶于水且水溶液呈碱性的分子是__________,它之所以极易溶于水是因为它的分子和水分子之间形成了______。
(6)![]() 的结构可表示为
的结构可表示为![]() ,与
,与![]() 结构最相似的分子是______,这两种结构相似的分子的极性__________(填“相同”或“不相同”),
结构最相似的分子是______,这两种结构相似的分子的极性__________(填“相同”或“不相同”),![]() 分子中有一个键的形成与另外两个键不同,它叫_______。
分子中有一个键的形成与另外两个键不同,它叫_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近成功合成了世界上首个五氮阴离子盐![]() (用
(用![]() 代表)。回答下列问题:
代表)。回答下列问题:
(1)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(![]() )。第二周期部分元素的
)。第二周期部分元素的![]() 变化趋势如图(a)所示,其中除氮元素外,其他元素的
变化趋势如图(a)所示,其中除氮元素外,其他元素的![]() 自左而右依次增大的原因是__________;氮元素的
自左而右依次增大的原因是__________;氮元素的![]() 呈现异常的原因是_________。
呈现异常的原因是_________。
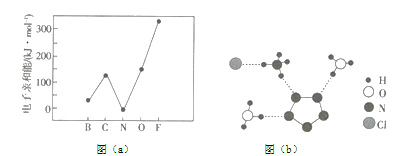
(2)经![]() 射线衍射测得化合物
射线衍射测得化合物![]() 的晶体结构,其局部结构如图(b)所示。
的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,![]() 中两种阳离子的相同之处为__________,不同之处为__________。(填标号)
中两种阳离子的相同之处为__________,不同之处为__________。(填标号)
A 中心原子的杂化轨道类型 B 中心原子的价层电子对数
C 立体结构 D 共价键类型
②![]() 中阴离子
中阴离子![]() 中的键总数为__________个。分子中的大
中的键总数为__________个。分子中的大![]() 键可用符号表示
键可用符号表示![]() ,其中
,其中![]() 代表参与形成大
代表参与形成大![]() 键的原子数,
键的原子数,![]() 代表参与形成大
代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() )则
)则![]() 中的大
中的大![]() 键应表示为__________。
键应表示为__________。
③图(b)中虚线代表氢键,其表示式为![]() 、__________、__________。
、__________、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )

A. 1 mol甲分子内含有10 mol共价键
B. 由乙分子构成的物质不能发生氧化反应
C. 丙分子的二氯取代产物只有三种
D. 分子丁是不可能合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,国家电投集团正在建设国内首座百千瓦级铁-铬液流电池储能示范电站。铁-铬液流电池总反应为Fe2+ + Cr3+![]() Fe3 + + Cr2+,工作示意图如图。下列说法错误的是
Fe3 + + Cr2+,工作示意图如图。下列说法错误的是
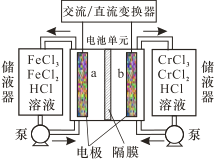
A.放电时a电极反应为 Fe 3++e- =Fe2+
B.充电时b电极反应为 Cr3++e- =Cr2+
C.放电过程中H+通过隔膜从正极区移向负极区
D.该电池无爆炸可能,安全性高,毒性和腐蚀性相对较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
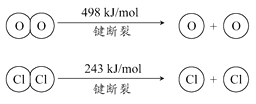
下列说法正确的是
A. 升高温度能提高HCl的转化率
B. 加入催化剂,能使该反应的焓变减小
C. 1molCl2转化为2molCl2原子放出243kJ热量
D. 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com