
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )

A. 1 mol甲分子内含有10 mol共价键
B. 由乙分子构成的物质不能发生氧化反应
C. 丙分子的二氯取代产物只有三种
D. 分子丁是不可能合成的
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )

A. 在NaCl晶体中,距Cl-最近的Na+有6个,距Na+最近且相等的Na+共12个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+,Ca2+的配位数是8
C. 在金刚石晶体中,每个碳原子被12个六元环共同占有,每个六元环最多有4个碳原子共面
D. 该气态团簇分子的分子式为EF或FE,其晶体不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、M、N四种有机物的有关信息如下表所示:
A | B | M | N |
比例模型为; | 球棍模型为: | 键线式结构为: | ①能与钠反应,但不能与NaOH溶液反应;②能与M反应生成相对分子质量为100的酯 |
请回答:
(1)A在一定条件下可合成包装塑料,反应的化学方程式为____________。
(2)在Ni作催化剂的条件下,B与氢气加热时反应的化学方程式为______________。
(3)M的分子式为__________,M与N反应的化学方程式为_______________。
(4)满足下列条件的M的同分异构体的结构简式为______________。
I:链状 ii:只含一种官能团 iii:能与新制氢氧化铜在加热条件下生成砖红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数的关系如图所示。Y与Z能形成Z2Y、Z2Y2型离子化合物R原子最外层电子数是电子层数的2倍,Z与T形成的化合物Z2T能破坏水的电离平衡。下列说法正确的是

A. 简单氢化物的热稳定性:R>Y
B. 简单离子的半径:Y>Z
C. 最高价氧化物对应水化物的酸性:R>T
D. Y与T属于同一主族、与X属于同一周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是人体必需的微量元素。含钴化合物作为颜料,具有悠久的历史,
在机械制造、磁性材料等领域也具有广泛的应用。请回答下列问题:
(1)Co基态原子的价电子排布图为______________________________;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用。其结构如图所示,中心离子为钴离子。

①酞菁钴中三种非金属原子的电负性由大到小的顺序为;______________(用相应的元素符号作答);碳原子的杂化轨道类型为______________;
②与钴离子通过配位键结合的氮原子的编号是______________;
(3)CoCl2中结晶水数目不同呈现不同的颜色。
![]()
CoCl2可添加到硅胶(一种干燥剂,烘干后可再生反复使用)中制成变色硅胶。简述硅胶中添加CoCl2的作用________________________________________________ ;
(4)用KCN处理含Co2+的盐溶液,有红色的Co(CN)2析出,将它溶于过量的KCN溶液后,可生成紫色的[Co(CN)6]4-,该配离子具有强还原性,在加热时能与水反应生成淡黄色[Co(CN)6]3-,写出该反应的离子方程式:________________________________________________;(提示:该反应在碱性环境中进行)
(5)Co的一种氧化物的晶胞如图所示,在该晶体中与一个钴原子等距离且最近的钴原子有_________个
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种很有前途的能源物质,制取大量氢气的最理想的途径是( )
A.用活泼金属跟HCl反应放出氢气
B.以焦炭和水制取水煤气后分离出氢气
C.在光触媒作用下利用太阳能分解水产生氢气
D.由火力发电站提供电力电解水产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中产生气泡速率最快的是( )
选项 | 温度 | 浓度 | 外加物质 |
A | 25℃ | 2 mL5%H2O2 | 2滴0.1mol·L-1FeCl3 |
B | 35℃ | 2mL8%H2O2 | 无 |
C | 35℃ | 2mL8%H2O2 | MnO2粉末 |
D | 25℃ | 2mL8%H2O2 | MnO2粉末 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
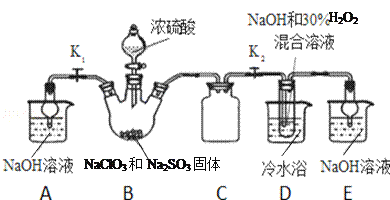
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_____________;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为___________________;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是_________________;检验该离子的方法是______________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com