
【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
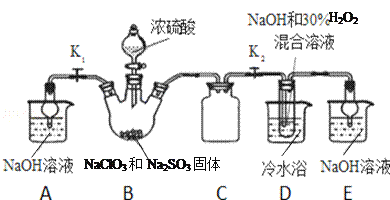
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_____________;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为___________________;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是_________________;检验该离子的方法是______________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为_________________。
【答案】 防止D瓶溶液倒吸到B瓶中 2NaClO3 +Na2SO3 + H2SO4= 2 ClO2↑+2Na2SO4+ H2O 2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2 SO42﹣ 取少量反应后的溶液于试管中,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42﹣ 趁热过滤 NaClO3和NaCl cV10﹣3mol
【解析】(1)由已知并结合实验装置图可得,B中生成的ClO2气体,进入D中与NaOH和H2O2反应制备NaClO2,故装置D中压强会降低,所以装置C的作用是作安全瓶,防止D瓶溶液倒吸到B瓶中。
(2)已知装置B中的产物有ClO2气体,所以B中NaClO3和Na2SO3在浓H2SO4的作用下发生氧化还原反应,NaClO3作氧化剂,Na2SO3作还原剂,故反应生成ClO2和Na2SO4,根据原子守恒和得失电子守恒,反应的化学方程式为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;ClO2进入装置D中与NaOH和H2O2反应制备NaClO2,Cl元素的化合价降低,则ClO2作氧化剂,H2O2作还原剂,有氧气生成,结合原子守恒可知,还有水生成,故化学方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;由装置B中反应物可推断,制得的气体中会含有SO2,SO2进入装置D中被氧化生成硫酸,故溶液中可能存在SO42-;可用氯化钡溶液检验SO42-的存在,具体操作为:取少量反应后的溶液于试管中,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-。
(3)从溶液中得到晶体,可采用蒸发结晶、过滤、洗涤、干燥的方法,由已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,所以为了防止温度过低而析出NaClO23H2O晶体,应该趁热过滤,控制温度38℃~60℃进行洗涤,低于60℃干燥。
(4)根据已知信息,应控制温度为38℃~60℃,若高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有NaClO3和NaCl杂质。
(5)设样品中NaClO2的物质的量为x,配制了100mL待测溶液,取25.00mL进行实验,根据已知反应列关系式:
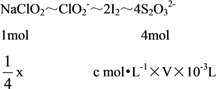 ,所以x=cV10-3mol。
,所以x=cV10-3mol。


科目:高中化学 来源: 题型:
【题目】实验室用锌粒与2mol/L硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
A.用锌粉代替锌粒B.滴入几滴硫酸铜溶液
C.改用5mol/L硫酸溶液D.改用冷的2mol/L硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】老师用下图所示装置为同学们做了一个兴趣实验。已知装置B、C、D中依次盛有紫色石蕊试液、足量的澄清石灰水和稀盐酸。小资料:HCl气体极易溶于水。

(1)打开A中的玻璃塞和活塞,B中实验现象是________________________。B中的现象不能说明二氧化碳与水反应的原因是________________________________________。
C中的化学反应的方程式是________________________________________________。
(2)一段时间后,关闭A中的活塞和玻璃塞,打开弹簧夹K2及E中的玻璃塞和活塞,待足量的过氧化氢溶液流入锥形瓶后,立即关闭E中的活塞,并用弹簧夹K2夹紧橡皮管。C中可能出现的现象是____________________________,解释C中呈现的现象的原因是______________________________________________________________________。
(3)将A中产生的气体通入过量的NaOH溶液中,为了确定反应后的溶液中含有NaOH 的实验方法为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)4.8 g碳在一定量的氧气中燃烧,反应后生成一氧化碳和二氧化碳混合气体的平均摩尔质量是40 g·mol-1,则生成的二氧化碳的质量是________,将混合气体依次通过氢氧化钠溶液和浓硫酸,最后收集在气球中,气球中收集到的气体其电子总数为__________。(用NA表示阿伏加德罗常数)
(2)某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为4A![]() B+2C+3D,测得生成的混合气体对甲烷的相对密度为 d/2,则A的相对分子质量为____________。
B+2C+3D,测得生成的混合气体对甲烷的相对密度为 d/2,则A的相对分子质量为____________。
(3)55g铁铝混合物与足量的稀硫酸反应生成标准状况下的氢气44. 8 L,则混合物中铁和铝的物质的量之比为___________。
(4)在100 g物质的量浓度为c mol·L-1,密度为ρ g·cm-3的硫酸中加入一定量的水稀释成 ![]() mol·L-1的硫酸,则加入水的体积________(填“=”、“>”或“<”)100 mL。
mol·L-1的硫酸,则加入水的体积________(填“=”、“>”或“<”)100 mL。
(5)将20.0 g氢氧化钠固体溶于水配成100 mL溶液,其密度为1.25 g·mL-1。该溶液中氢氧化钠的物质的量浓度为___________,质量分数为__________,从该溶液中取出10 mL,将其加水稀释到100 mL,稀释后溶液中氢氧化钠的物质的量浓度为__________,将一定体积的原溶液和稀释后的溶液按1∶4的体积比混合(忽略混合时溶液体积变化),所得混合溶液中氢氧化钠的物质的量浓度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:C2H5OH+NaBr+H2SO4(浓) ![]() NaHSO4+C2H5Br+H2O,实验室用如图所示装置制备溴乙烷(沸点为38.4 ℃,密度为1.43 g·mL-l)。
NaHSO4+C2H5Br+H2O,实验室用如图所示装置制备溴乙烷(沸点为38.4 ℃,密度为1.43 g·mL-l)。

实验前先向仪器a 中加入10 g 乙醇和足量浓硫酸,然后加入研细的20.6g 溴化钠和几粒碎瓷片,向试管d中加人少量蒸馏水。
回答下列问题:
(1)加入碎瓷片的作用是__________________________。
(2)为了更好的控制反应温度,除用图示的加热方法外,更好的加热方法是_______________________。
(3)试管d 中出现的实验现象是__________________________。
(4)反应结束后,试管d中含少量杂质Br2,为了除去粗产品中的杂质Br2,可选用的试剂是________(填字母)
A.苯 B.H2O C.Na2SO3溶液 D.CCl4
(5)经过分离、提纯、干燥后,该实验最终得到8.7g溴乙烷,则本实验溴乙烷的产率为__________。
(6)通过以下几项实验步骤可检验溴乙烷中的溴元素,其正确的操作顺序是取少量溴乙烷,__________(填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列有关叙述正确的是
A. 46g乙醇与甲酸混合物中,含有的氧原子数为NA
B. 1L0.1mol/L的CH3COONa溶液中,Na+数为0.1NA
C. 标准状况下,5.6LNO和O2的混合气体中含有的分子数为0.25NA
D. 常温下,14g铁皮与足量浓硝酸反应,转移的电子数为0.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是()
A. 偏二甲肼(C2H8N2)的摩尔质量为60g
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C. 1mol偏二甲肼(C2H8N2)的质量为60g/mol
D. 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示。下列说法正确的是( )

A.由 X→Z 反应的 ΔH<0 B.由 X→Y 反应的 ΔH=E5-E2
C.增大压强有利于提高 Y 的产率 D.升高温度有利于提高 Z 的产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com