
����Ŀ����֪��Ӧ��C2H5OH+NaBr+H2SO4(Ũ) ![]() NaHSO4+C2H5Br+H2O��ʵ��������ͼ��ʾװ���Ʊ�������(�е�Ϊ38.4 �棬�ܶ�Ϊ1.43 g��mL-l)��
NaHSO4+C2H5Br+H2O��ʵ��������ͼ��ʾװ���Ʊ�������(�е�Ϊ38.4 �棬�ܶ�Ϊ1.43 g��mL-l)��

ʵ��ǰ��������a �м���10 g �Ҵ�������Ũ���ᣬȻ�������ϸ��20.6g �廯�ƺͼ������Ƭ�����Թ�d�м�����������ˮ��
�ش��������⣺
��1���������Ƭ��������__________________________��
��2��Ϊ�˸��õĿ��Ʒ�Ӧ�¶ȣ�����ͼʾ�ļ��ȷ����⣬���õļ��ȷ�����_______________________��
��3���Թ�d �г��ֵ�ʵ��������__________________________��
��4����Ӧ�������Թ�d�к���������Br2��Ϊ�˳�ȥ�ֲ�Ʒ�е�����Br2����ѡ�õ��Լ���________(����ĸ)
A.�� B.H2O C.Na2SO3��Һ D.CCl4
��5���������롢�ᴿ�������ʵ�����յõ�8.7g�����飬��ʵ��������IJ���Ϊ__________��
��6��ͨ�����¼���ʵ�鲽��ɼ����������е���Ԫ�أ�����ȷ�IJ���˳����ȡ���������飬__________������ţ���
�ټ��� �ڼ���AgNO3��Һ �ۼ���ϡHNO3�ữ �ܼ���NaOH��Һ ����ȴ
���𰸡� ��ֹҺ�屩�� ˮԡ���� Һ��ֲ㣬�²�Ϊ��״Һ�� C 40% �ܢ٢ݢۢ�
����������1����ͼװ����Ҫ�þƾ��ƶ�װ��a�������������Ƭ����Ӵ��������ֹҺ����ֲ����ȶ����У��ʴ�Ϊ����ֹҺ�屩����
��2������������ķе���38.4�棬����Ϊ�˸��õĿ��Ʒ�Ӧ�¶ȣ�����ͼʾ��С����ȣ����õļ��ȷ�ʽ��ˮԡ���ȡ�
��3��������ķе�ͣ������ڱ�ˮ����ȴ������̬���Һ̬�����Թ�d�пɹ۲쵽Һ��ֲ㣬�²�Ϊ��״Һ����
��4�����ɵ��������к���������Br2����Br2����ǿ�����ԣ�����Ϊ�˳�ȥ�ֲ�Ʒ�е�����Br2��Ӧѡ����л�ԭ�Ե�����������Һ����ѡC��
��5��20.6g�廯�Ƶ����ʵ���Ϊ��20.6g��103g/mol=0.2mol��10g�Ҵ������ʵ���Ϊ��10g��46g/mol>0.2mol�����ݻ�ѧ����ʽ�ɵ��廯�ƺ��Ҵ������������ʵ���֮��Ϊ1��1��1����������������۲���Ϊ��0.2mol��109g/mol=21.8g����Ϊ��ʵ�����յõ�8.7g�����飬��ʵ��������IJ���Ϊ��8.7g��21.8g��100%��40%��
��6��Ҫ��������������Ԫ�أ�����ʹ���������������Ƶ�ˮ��Һ��ˮ�⣬Ȼ���ټ��������к��������ƣ���������������Һ��������ȷ�IJ���˳���Ǣܢ٢ݢۢڡ�


 ȫ��������ϵ�д�
ȫ��������ϵ�д� һ��һ����ʱ���ϵ�д�
һ��һ����ʱ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ m g ij���壬���ķ������ĸ�ԭ�ӹ��ɣ�����Ħ������Ϊ M g��mol��1����
��1������������ʵ���Ϊ_____mol��
��2����������������ԭ������Ϊ_____����
��3���������ڱ�״���µ����Ϊ_____L��
��4������������ 1 L ˮ��(�����Ƿ�Ӧ)������Һ�����ʵ���������Ϊ_____��
��5������������ˮ���γ� V L ��Һ������Һ�����ʵ���Ũ��Ϊ_____mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCl3��CuCl2�Ļ����Һ�м������ۣ���ַ�Ӧ�����й�����ڣ��������жϲ���ȷ����
A. ����KSCN��Һһ�������ɫ B. ��Һ��һ����Fe2+
C. ��Һ��һ������Cu2+ D. ʣ�������һ����Cu
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾʵ��װ�ã��ش��������⣺

��1��д���������������ƣ���__________����_________����_________����__________��
��2������������ʵ��֮ǰ����װ���Ƿ��©ˮ����_____________________�����������ƣ���
��3������װ�����Ʊ�����ˮʱ������ˮӦ��___________������f������g�����ڽ��롣
��4������װ�����ӵ�ˮ����ȡ�⣬��ѡ�����ȡ��Ϊ____�������ƾ�������������������Һǰ��Ӧ�Ƚ���Һ©���Ͽڲ�������ʹ���ϵİ��۶���Һ©���ϵ�С�ף��˲�����Ŀ����______��
��5��װ������һ�����ԵĴ�����____________________________________________________��
��6������װ�â�����ʵ��ʱ��Ӧע��IJ���������____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2������ҪƯ����̽��С�鿪չ����ʵ�飬�ش��������⣺
ʵ��������ȡNaClO2���尴����ͼװ�ý�����ȡ��
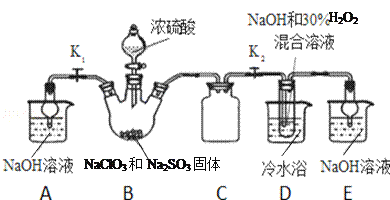
��֪��NaClO2������Һ�ڵ���38��ʱ����NaClO23H2O������38��ʱ����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��
��1��װ��C��������_____________��
��2����֪װ��B�еIJ�����ClO2���壬��װ��B�з�Ӧ�Ļ�ѧ����ʽΪ___________��װ��D�з�Ӧ����NaClO2�Ļ�ѧ����ʽΪ___________________��װ��B�з�Ӧ�����Һ�������ӳ���ClO2����ClO3����Cl����ClO����OH������ܺ��е�һ����������_________________����������ӵķ�����______________________________��
��3���벹���װ��D��Ӧ�����Һ�л��NaClO2����IJ������衣
�ټ�ѹ��55�������ᾧ����____________������38�桫60����ˮϴ�ӣ��ܵ���60���������õ���Ʒ��
��4�������ȥD�е���ˮԡ�����ܵ��²�Ʒ�л��е�������_______________��
ʵ��������Ʒ���ʷ����봿�Ȳⶨ
��5���ⶨ��Ʒ��NaClO2�Ĵ��ȣ��ⶨʱ��������ʵ�飺
ȷ��һ����������Ʒ��������������ˮ������KI���壬�����������·������·�Ӧ��ClO2��+4I��+4H+=2H2O+2I2+Cl���������û��Һϡ�ͳ�100mL������Һ��ȡ25.00mL������Һ�����������Һ��ָʾ������c molL��1 Na2S2O3��Һ�ζ����յ㣬������ı���Һ�����ƽ��ֵΪV mL����֪��I2+2S2O32��=2I��+S4O62���������������ȡ����Ʒ��NaClO2�����ʵ���Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����xgKNO3��������Һ�У�����agKNO3��������bgˮ�ָ�����������Һ���ﵽ���ͣ��ݴ��������۴������
A. ������ʱ��KNO3���ܽ��Ϊ100a/b g
B. ��ԭ��Һ��������������Ϊ![]() ����x��2b
����x��2b
C. ��ԭ��������Һ������2b gˮ���ָ���ԭ�¶ȣ�������2a gKNO3
D. ������ʱ����õ�KNO3��Һ����������������![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������10mL pH=3�Ĵ�����Һ�м���ˮϡ�ͺ�������˵����ȷ����
A. ��Һ�е������ӵ���Ŀ���ӣ���������ǿ
B. ����ĵ���̶�����c(H��)������
C. �ټ���10mL pH=11 NaOH��Һ�����ҺpH=7
D. ��Һ��c(CH3COO-)/[c(CH3COOH)��c(OH-)]����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 mol SO2��1 mol O2����һ�ݻ��̶����ܱ������У���һ�������·�����Ӧ��2SO2(g)��O2(g) ![]() 2SO3(g)���������������ٸı�ʱ��������˵����ѧ��Ӧ�Ѵﵽƽ��״̬����(����)
2SO3(g)���������������ٸı�ʱ��������˵����ѧ��Ӧ�Ѵﵽƽ��״̬����(����)
A. ���������ܶ�
B. ��������ѹǿ
C. �������������ʵ���
D. ��������ƽ����Է�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����У��е���ת��Ϊ��ѧ�ܵ��ǣ� ��
A.���ֻ�
B.�������
C.���ˮ
D.��ȼ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com