
【题目】将2 mol SO2和1 mol O2充入一容积固定的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g) ![]() 2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
2SO3(g),下列物理量不再改变时,并不能说明化学反应已达到平衡状态的是( )
A. 混合气体的密度
B. 混合气体的压强
C. 混合气体的总物质的量
D. 混合气体的平均相对分子质量
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】如图所示,常温下通电5 ![]() 后,发现铜电极的质量增加,试回答:
后,发现铜电极的质量增加,试回答:

(1)电源电极![]() 的名称为________(填“正极”或“负极”)。
的名称为________(填“正极”或“负极”)。
(2)电解池![]() 中阳极的电极反应式是____________。
中阳极的电极反应式是____________。
(3)若![]() 溶液的体积是200
溶液的体积是200 ![]() ,则当铜电极的质量增加2. 16
,则当铜电极的质量增加2. 16 ![]() 时
时![]() 中溶液的
中溶液的![]() ____________ (忽略电解前后溶液体积的变化),若要使电解后的溶液恢复到与电解前完全相同的状态,则应加入____________(填物质的种类及数量)。
____________ (忽略电解前后溶液体积的变化),若要使电解后的溶液恢复到与电解前完全相同的状态,则应加入____________(填物质的种类及数量)。
(4)已知电解前,电解池B中铜银两电极的质量相等,通电一段时间后,当铜银两电极的质量差为2.16 ![]() 时,电解池A中生成的气体最多为________
时,电解池A中生成的气体最多为________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:C2H5OH+NaBr+H2SO4(浓) ![]() NaHSO4+C2H5Br+H2O,实验室用如图所示装置制备溴乙烷(沸点为38.4 ℃,密度为1.43 g·mL-l)。
NaHSO4+C2H5Br+H2O,实验室用如图所示装置制备溴乙烷(沸点为38.4 ℃,密度为1.43 g·mL-l)。

实验前先向仪器a 中加入10 g 乙醇和足量浓硫酸,然后加入研细的20.6g 溴化钠和几粒碎瓷片,向试管d中加人少量蒸馏水。
回答下列问题:
(1)加入碎瓷片的作用是__________________________。
(2)为了更好的控制反应温度,除用图示的加热方法外,更好的加热方法是_______________________。
(3)试管d 中出现的实验现象是__________________________。
(4)反应结束后,试管d中含少量杂质Br2,为了除去粗产品中的杂质Br2,可选用的试剂是________(填字母)
A.苯 B.H2O C.Na2SO3溶液 D.CCl4
(5)经过分离、提纯、干燥后,该实验最终得到8.7g溴乙烷,则本实验溴乙烷的产率为__________。
(6)通过以下几项实验步骤可检验溴乙烷中的溴元素,其正确的操作顺序是取少量溴乙烷,__________(填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F都是元素周期表中前36号元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,C原子基态时s电子数与p电子数相等,D在元素周期表的各元素中电负性最大,E的基态原子核外有6个能级且全部充满电子,F原子基态时未成对电子数是同周期元素中最多的。
(1)F元素的名称是________ ,基态F原子的价电子轨道表示式_________画出AC2的电子式_______________E元素常见离子的电子排布式______________。
(2)A、B、C的电负性大小顺序(填元素符号,下同)______________,第一电离能大小顺序为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可作为航天运载火箭的推动力.下列叙述正确的是()
A. 偏二甲肼(C2H8N2)的摩尔质量为60g
B. 6.02×1023个偏二甲肼(C2H8N2)分子的质量为60g
C. 1mol偏二甲肼(C2H8N2)的质量为60g/mol
D. 6g偏二甲肼(C2H8N2)含有NA个偏二甲肼(C2H8N2)分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧熔融碳酸盐燃料电池是一种高温电池(600~700℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是
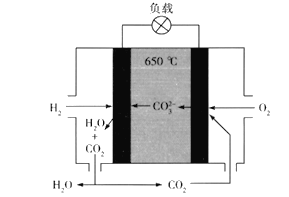
A. 电池工作时,熔融碳酸盐只起到导电的作用
B. 负极反应式为H2 -2e- +CO32-==CO2+H2O
C. 该电池可利用工厂中排出的CO2,减少温室气体的排放
D. 电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是

A. A、B、C是气体,D不是气体
B. A、B是气体,C、D有一种是气体
C. C、D是气体,A、B有一种是气体
D. C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计及其对应的离子方程式均正确的是( )
A. 将稀硫酸加入到大苏打溶液中:S2O32-+2H+=S↓+SO2↑+H2O
B. 用铁为电极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. Ca(C1O)2溶液中通入少量SO2气体:Ca2++2C1O-+SO2+H2O=CaSO3↓+2HC1O
D. 用浓盐酸酸化的KMnO4溶液与H2C2O4反应,反应的离子方程式为:2MnO4—+6H++5H2C2O4=2Mn2+ +10CO2↑ +8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮、硫、碳及其化合物的转化对于环境的改善有重大意义,可减少如雾霾天气、酸雨、酸雾等环境污染问题。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2 (g)△H=____kJ·mol-1;
CO2(g)+2H2O(g)+N2 (g)△H=____kJ·mol-1;
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)![]() 2SO3(g)。在一定温度和压强下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强在不同温度下与反应时间如图1所示。
2SO3(g)。在一定温度和压强下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强在不同温度下与反应时间如图1所示。

① 图1中C点时,SO2的转化率为_______。
② 图1中B点的压强平衡常数Kp=_______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)已知4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH1=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图2所示。
5N2(g)+6H2O(g) ΔH1=-1800 kJ·mol-1,将2 mol NH3、3 mol NO的混合气体分别置于a、b、c三个10 L恒容密闭容器中,使反应在不同条件下进行,反应过程中c(N2)随时间的变化如图2所示。

①与容器a中的反应相比,容器b中的反应改变的实验条件可能是_______,判断的依据是______________________________________。
②一定温度下,下列能说明反应已达到平衡状态的是____
A.H2O(g)与NO的生成速率相等 B.混合气体的密度保持不变
C.ΔH保持不变 D.容器的总压强保持不变
(4)利用人工光合作用,借助太阳能使CO2和H2O转化为HCOOH,如图3所示,在催化剂b表面发生的电极反应为:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com