
【题目】(1)4.8 g碳在一定量的氧气中燃烧,反应后生成一氧化碳和二氧化碳混合气体的平均摩尔质量是40 g·mol-1,则生成的二氧化碳的质量是________,将混合气体依次通过氢氧化钠溶液和浓硫酸,最后收集在气球中,气球中收集到的气体其电子总数为__________。(用NA表示阿伏加德罗常数)
(2)某物质A在一定条件下加热完全分解,产物都是气体。分解方程式为4A![]() B+2C+3D,测得生成的混合气体对甲烷的相对密度为 d/2,则A的相对分子质量为____________。
B+2C+3D,测得生成的混合气体对甲烷的相对密度为 d/2,则A的相对分子质量为____________。
(3)55g铁铝混合物与足量的稀硫酸反应生成标准状况下的氢气44. 8 L,则混合物中铁和铝的物质的量之比为___________。
(4)在100 g物质的量浓度为c mol·L-1,密度为ρ g·cm-3的硫酸中加入一定量的水稀释成 ![]() mol·L-1的硫酸,则加入水的体积________(填“=”、“>”或“<”)100 mL。
mol·L-1的硫酸,则加入水的体积________(填“=”、“>”或“<”)100 mL。
(5)将20.0 g氢氧化钠固体溶于水配成100 mL溶液,其密度为1.25 g·mL-1。该溶液中氢氧化钠的物质的量浓度为___________,质量分数为__________,从该溶液中取出10 mL,将其加水稀释到100 mL,稀释后溶液中氢氧化钠的物质的量浓度为__________,将一定体积的原溶液和稀释后的溶液按1∶4的体积比混合(忽略混合时溶液体积变化),所得混合溶液中氢氧化钠的物质的量浓度为____________。
【答案】13.2 g1.4 NA12 d1∶2<5 mol/L16%0.5 mol/L1.4 mol/L
【解析】
(1)4.8g碳物质的量=![]() =0.4mol,反应后生成CO和CO2混合气体物质的量为0.4mol,混合气体平均摩尔质量是40g/mol,则混合气体质量=40g/mol×0.4mol=16.0g,设一氧化碳物质的量为x,二氧化碳物质的量为(0.4-x)mol,28x+44×(0.4-x)=16.0,解得:x=0.1mol,则二氧化碳质量=0.3mol×44g/mol=13.2g,将混合气体依次通过氢氧化钠溶液和浓硫酸,最后收集在气球中,气球中的气体为一氧化碳,含有的电子为0.1mol×(6+8)=1.4mol,数目为1.4 NA,故答案为:13.2;1.4 NA;
=0.4mol,反应后生成CO和CO2混合气体物质的量为0.4mol,混合气体平均摩尔质量是40g/mol,则混合气体质量=40g/mol×0.4mol=16.0g,设一氧化碳物质的量为x,二氧化碳物质的量为(0.4-x)mol,28x+44×(0.4-x)=16.0,解得:x=0.1mol,则二氧化碳质量=0.3mol×44g/mol=13.2g,将混合气体依次通过氢氧化钠溶液和浓硫酸,最后收集在气球中,气球中的气体为一氧化碳,含有的电子为0.1mol×(6+8)=1.4mol,数目为1.4 NA,故答案为:13.2;1.4 NA;
(2)相同条件下,气体的相对分子质量和气体的密度成正比,所以三种气体的平均相对分子质量为![]() ×16=8d,右边相对分子质量总和为8d+2×8d+3×8d=48d,根据质量守恒定律,左边4A的质量也是48d,所以,A的相对分子质量为12d。故答案为:12d;
×16=8d,右边相对分子质量总和为8d+2×8d+3×8d=48d,根据质量守恒定律,左边4A的质量也是48d,所以,A的相对分子质量为12d。故答案为:12d;
(3)标准状况下44.8L氢气的物质的量为:n(H2)=![]() =2mol。设混合物中含有Fe、Al的物质的量分别为x、y,已知反应:Fe+2HCl=FeCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,则
=2mol。设混合物中含有Fe、Al的物质的量分别为x、y,已知反应:Fe+2HCl=FeCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,则
Fe+2HCl=FeCl2+H2↑
x x
2Al+6HCl=2AlCl3+3H2↑
y ![]()
则有:x ×56g/mol+y ×27g/mol=55g,x+![]() =2mol,解得:x=0.5mol,y=1mol,所以n(Fe)∶n(Al)=x∶y=0.5mol∶1mol=1∶2,故答案为:1∶2;
=2mol,解得:x=0.5mol,y=1mol,所以n(Fe)∶n(Al)=x∶y=0.5mol∶1mol=1∶2,故答案为:1∶2;
(4)硫酸溶液的密度大于1g/mL,且浓度越大,密度越大,100g浓硫酸的体积小于100mL,若加入100g水,则稀释后硫酸的体积大于原来的2倍,浓硫酸浓度要缩小一半,则溶液体积需要扩大1倍,所以加入水的体积应该小于100mL,故答案为:<;
(5)20.0g氢氧化钠的物质的量为:![]() =0.5mol/L,该氢氧化钠溶液的浓度为
=0.5mol/L,该氢氧化钠溶液的浓度为![]() =5mol/L,溶液的质量为1.25 g·mL-1×100 mL=125g,氢氧化钠的质量分数=
=5mol/L,溶液的质量为1.25 g·mL-1×100 mL=125g,氢氧化钠的质量分数=![]() ×100%=16%;将取出的10mL溶液加水稀释到100mL,稀释过程中氢氧化钠的物质的量不变,则稀释后溶液中NaOH的物质的量浓度为
×100%=16%;将取出的10mL溶液加水稀释到100mL,稀释过程中氢氧化钠的物质的量不变,则稀释后溶液中NaOH的物质的量浓度为![]() =0.5mol/L;将一定体积的原溶液和稀释后的溶液按1∶4的体积比混合(忽略混合时溶液体积变化),所得混合溶液中氢氧化钠的物质的量浓度为
=0.5mol/L;将一定体积的原溶液和稀释后的溶液按1∶4的体积比混合(忽略混合时溶液体积变化),所得混合溶液中氢氧化钠的物质的量浓度为![]() =1.4 mol/L;故答案为:0.5mol/L;16%;0.5 mol/L;1.4 mol/L。
=1.4 mol/L;故答案为:0.5mol/L;16%;0.5 mol/L;1.4 mol/L。


科目:高中化学 来源: 题型:
【题目】对于电解质的导电能力,下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B.导电能力强的溶液一定是浓溶液
C.相同温度下,导电能力强的溶液中离子个数一定多
D.相同的温度下,单位体积中的离子个数越多,阴离子或阳离子所带电荷的绝对值越大,溶液的导电能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用干燥洁净的铂丝蘸取某试样灼烧时,焰色反应为黄色,下列判断正确的是( )
A.该试样一定是钠的化合物B.该试样一定含有钠元素
C.该试样一定是金属钠D.不能确定该试样中是否含有钠元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的NH3和CH4两种气体,下列有关说法错误的是
A. 所含分子数之比为16∶17 B. 所含电子数之比为16∶17
C. 所含氢元素的质量之比为17∶16 D. 密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的流程如下:
![]()
(1)写出②中除烧杯外还要用到的玻璃仪器的名称:_______。
(2)有同学试图利用蒸馏方法来实现第③步操作,该同学设计了如下图蒸馏实验装置,此装置中的明显错误之处为____________ 、______________。

(3)实际操作时,利用蒸馏方法分离I2的CCl4溶液获
得I2的量大 大少于预期,试分析其主要原
因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
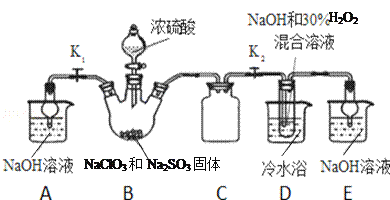
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_____________;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为___________________;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是_________________;检验该离子的方法是______________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )

A. X和R在同一周期
B. 原子半径:W>R>X
C. 气态氢化物的稳定性:Y>X
D. X、Z形成的化合物中只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域可以寻找制备新型农药材料的元素,它们是( )
A.左下方区域的金属元素
B.右上方区域的某些非金属元素
C.金属元素和非金属元素分界线附近的元素
D.过渡元素区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. CO的平衡转化率为80%
C. 通入CO后,正反应速率逐渐增大
D. 反应前H2S物质的量为7 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com