
【题目】下列反应中产生气泡速率最快的是( )
选项 | 温度 | 浓度 | 外加物质 |
A | 25℃ | 2 mL5%H2O2 | 2滴0.1mol·L-1FeCl3 |
B | 35℃ | 2mL8%H2O2 | 无 |
C | 35℃ | 2mL8%H2O2 | MnO2粉末 |
D | 25℃ | 2mL8%H2O2 | MnO2粉末 |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。

(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示0~2分钟内的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想合成具有以下结构的四种烃分子,下列有关说法不正确的是( )

A. 1 mol甲分子内含有10 mol共价键
B. 由乙分子构成的物质不能发生氧化反应
C. 丙分子的二氯取代产物只有三种
D. 分子丁是不可能合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若在已达到平衡的2SO2 + O2 ![]() 2SO3反应体系中,充入少量的18O2,一段时间后,18O这种原子存在于
2SO3反应体系中,充入少量的18O2,一段时间后,18O这种原子存在于
A. O2B. SO2C. SO3D. O2、SO2、SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-![]() 2AlO2-+H2↑
2AlO2-+H2↑
C. 室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. 用酸性高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的是( )
A.  制取乙酸乙酯
制取乙酸乙酯
B.  吸收NH3
吸收NH3
C.  石油的分馏
石油的分馏
D.  比较盐酸、碳酸、苯酚的酸性强弱
比较盐酸、碳酸、苯酚的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置(略去部分夹持仪器,气密性己检验)生产硷代硫酸钠晶体(Na2S2O3·5H2O)。实验步骤是先向装置①的烧瓶中滴加80%的浓H2SO4;充分反应后过滤装置③中混合物,滤液经结晶即得到产品。
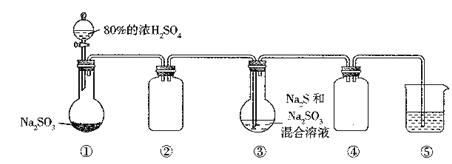
已知:2Na2S+Na2SO3+3SO2=3Na2S2O3。下列判断不正确的是
A. 应用装置①,利用H2O2和MnO2可制取少量O2
B. 实验过程中,装置②和装置④的作用相同
C. 装置③中⑤Na2S和Na2SO3的物须的量之比最好为1:2
D. 装置⑤中盛有NaOH溶液、可吸收多余的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三组实验进行一段时间后,溶液中均有白色沉淀生成,下列结论不正确的是
实验① | 实验② | 实验③ |
|
|
|
A. 实验①中生成的沉淀是BaCO3
B. 实验①中有气体生成
C. 实验②沉淀中可能含有BaSO4
D. 实验③生成沉淀的离子方程式是:Ba2++ H2SO3===BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)物质的量浓度相等的CH3COONa溶液和NaClO溶液pH大小关系为:c(CH3COONa)_____c(NaClO)(填“>”、“<”或“=”)。
(2)H2CO3的电离方程式为:_____。
(3)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:_____。
(4)泡沫灭火器内筒装有Al2(SO4)3溶液,外筒装有NaHCO3溶液。
① Al2(SO4)3溶液呈酸性的原因是:_____。(用离子方程式说明)
② 内、外筒溶液混合后发生反应离子方程式为:_____。
(5)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变大的是______。
A.c(H+) B.c(H+)·c(OH-)
C. ![]() D.
D.![]()
(6)H+浓度相等、体积相等的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应后,仅有一份溶液中剩余锌,放出氢气的质量相同,则下列说法正确的是 __(填写序号)。
①开始反应时的速率A>B ②放出等量氢气所需要的时间B>A
③参加反应的锌的物质的量A=B ④A中有锌剩余
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com