
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)物质的量浓度相等的CH3COONa溶液和NaClO溶液pH大小关系为:c(CH3COONa)_____c(NaClO)(填“>”、“<”或“=”)。
(2)H2CO3的电离方程式为:_____。
(3)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:_____。
(4)泡沫灭火器内筒装有Al2(SO4)3溶液,外筒装有NaHCO3溶液。
① Al2(SO4)3溶液呈酸性的原因是:_____。(用离子方程式说明)
② 内、外筒溶液混合后发生反应离子方程式为:_____。
(5)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变大的是______。
A.c(H+) B.c(H+)·c(OH-)
C. ![]() D.
D.![]()
(6)H+浓度相等、体积相等的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应后,仅有一份溶液中剩余锌,放出氢气的质量相同,则下列说法正确的是 __(填写序号)。
①开始反应时的速率A>B ②放出等量氢气所需要的时间B>A
③参加反应的锌的物质的量A=B ④A中有锌剩余
【答案】 < H2CO3 ![]() HCO
HCO![]() +H+ HCO3-
+H+ HCO3- ![]() CO32- + H+ (或H2CO3
CO32- + H+ (或H2CO3 ![]() HCO
HCO![]() +H+) ClO- + CO2 + H2O = HCO3- + HclO Al3+ + 3H2O
+H+) ClO- + CO2 + H2O = HCO3- + HclO Al3+ + 3H2O ![]() Al(OH)3 + 3H+ Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑ C ③④
Al(OH)3 + 3H+ Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑ C ③④
【解析】(1)根据表中数据可以知道,酸的电离出平衡常数大小为:CH3COOH>H2CO3>HClO>HCO3-,电离平衡常数越大,酸性越强,对应的盐水解越弱;
(2)H2CO3为二元弱酸,分两步电离,以第一步为主,电离方程式为:H2CO3 ![]() HCO
HCO![]() +H+ HCO3-
+H+ HCO3- ![]() CO32- + H+ ;
CO32- + H+ ;
(3)因为酸性H2CO3>HClO>HCO3-,根据强制弱规律,向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:ClO- + CO2 + H2O = HCO3- + HClO ;
(4)① Al2(SO4)3溶液中由于Al3+水解而呈酸性。
② Al2(SO4)3溶液和NaHCO3溶液混合,发生相互促进水解;
(5)A.0.1 molL-1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小;
B、KW=c(H+)·c(OH-)只受温度的影响,温度不变则其值是一个常数;
C.0.1 molL-1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,所以![]() 增大;
增大;
D.![]() =Kw/Ka,为常数,因为温度不变则常数不变;
=Kw/Ka,为常数,因为温度不变则常数不变;
(6)由于醋酸部分电离,其酸的浓度大于氢离子浓度,盐酸中HCl的浓度等于氢离子的浓度,所以醋酸的浓度大于HCl的浓度,则盐酸中锌粉剩余,以此解答该题。
详解:(1)根据表中数据可以知道,酸的电离出平衡常数大小
为:CH3COOH>H2CO3>HClO>HCO3-,电离平衡常数越大,酸性越强,对应的盐水解越弱,所以pH大小关系为:c(CH3COONa)<c(NaClO),
因此,本题正确答案是:<;
(2)H2CO3为二元弱酸,分两步电离,以第一步为主,电离方程式为:H2CO3 ![]() HCO
HCO![]() H+ , HCO3-
H+ , HCO3- ![]() CO32- + H+
CO32- + H+
因此,本题正确答案是:H2CO3 ![]() HCO
HCO![]() +H+ , HCO3-
+H+ , HCO3- ![]() CO32- + H+ ;
CO32- + H+ ;
(3)因为酸性H2CO3>HClO>HCO3-,根据强制弱规律,向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:ClO- + CO2 + H2O = HCO3- + HClO
因此,本题正确答案是:ClO- + CO2 + H2O = HCO3- + HClO ;
(4)① Al2(SO4)3溶液中由于Al3+水解而呈酸性,离子方程式为:Al3+ + 3H2O ![]() Al(OH)3 + 3H+。
Al(OH)3 + 3H+。
② Al2(SO4)3溶液和NaHCO3溶液混合,发生相互促进水解,反应进行完全,离子方程式为: Al3+ + 3HCO3- = Al(OH)3↓+ 3CO2↑。
(5)A.0.1 molL-1的CH3COOH溶液加稀释过程中,溶液中氢离子浓度减小,所以A选项是错误的;
B、KW=c(H+)·c(OH-)只受温度的影响,温度不变则其值是一个常数,故B错误;
C.0.1 molL-1的CH3COOH溶液加稀释过程中,各个微粒浓度减小,同时醋酸的电离向右移动,c(H+)减小的程度小于c(CH3COOH)的减小程度,所以![]() 增大,故C正确;
增大,故C正确;
D.![]() =Kw/Ka,为常数,因为温度不变则常数不变,故D错误;
=Kw/Ka,为常数,因为温度不变则常数不变,故D错误;
因此,本题正确答案是:C。
(6)① 开始pH相同,则氢离子浓度相同,所以开始时反应速率A=B,故① 错误;
② 由于醋酸中酸过量,则反应较快,所以反应所需的时间A>B;故② 错误;
③ 由于生成的氢气体积相同,所以参加反应的锌粉物质的量A=B,故③ 正确;
④ 醋酸的浓度大于盐酸的浓度,醋酸有剩余,则盐酸中有锌粉剩余,故④ 正确;
故选③ ④。


科目:高中化学 来源: 题型:
【题目】下列反应中产生气泡速率最快的是( )
选项 | 温度 | 浓度 | 外加物质 |
A | 25℃ | 2 mL5%H2O2 | 2滴0.1mol·L-1FeCl3 |
B | 35℃ | 2mL8%H2O2 | 无 |
C | 35℃ | 2mL8%H2O2 | MnO2粉末 |
D | 25℃ | 2mL8%H2O2 | MnO2粉末 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取。
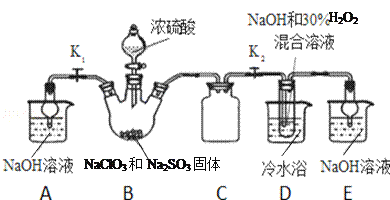
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
(1)装置C的作用是_____________;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的化学方程式为___________;装置D中反应生成NaClO2的化学方程式为___________________;装置B中反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是_________________;检验该离子的方法是______________________________;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水洗涤;④低于60℃干燥;得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______________;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。请计算所称取的样品中NaClO2的物质的量为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关,键能可以简单的理解为断开1mol化学键时所吸收的能量或生成1mol化学键时所释放的能量。下表是部分化学键的键能数据:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ·mol-1 | 197 | X | 499 | 434 |
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),1mol白磷完全燃烧放出热量2378.0kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物P4O10结构如图所示,则上表中X约为

A. 410B. 335C. 360D. 188
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是( )
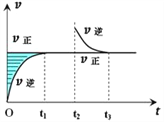
A. Z和W在该条件下一定不为气态
B. t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C. 若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度相等
D. 若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取0.lmolL-1 HA溶液与0.1 molL-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因_____(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)___0.1 molL-1NaOH 溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(3)所得混合液中各离子浓度从大到小的顺序为:____。
(4)混合液中: c(HA)+ c(A-)=_______ molL-1。c(Na+)-c(A-)=_______molL-1。
(5)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的 pH________7(填“>”、“<”或“=”)。
(6)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序____(填字母)。
A.NH4HCO3 B.NH4A C.NH4HSO4 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀H2SO4 和稀HNO3的混合液1L,其物质的量浓度分别为0.4mol·L-1和0.1mol·L-1。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量为( )
A. 2.4gB. 3.2gC. 6.4gD. 9.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com