
【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关,键能可以简单的理解为断开1mol化学键时所吸收的能量或生成1mol化学键时所释放的能量。下表是部分化学键的键能数据:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ·mol-1 | 197 | X | 499 | 434 |
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),1mol白磷完全燃烧放出热量2378.0kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物P4O10结构如图所示,则上表中X约为

A. 410B. 335C. 360D. 188
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2![]() 2Mn2++5O2↑+8H2O
2Mn2++5O2↑+8H2O
B. 用氢氧化钠溶液除去镁粉中的杂质铝:2Al+2OH-![]() 2AlO2-+H2↑
2AlO2-+H2↑
C. 室温下测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. 用酸性高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
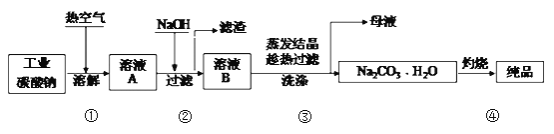
下列说法不正确的是
A. 步骤①,通入热空气可加快溶解速率
B. 步骤②,产生滤渣的离子反应为:Mg2+ + Fe3+ + 5OH- == Mg(OH)2↓+ Fe(OH)3↓
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3H2O中混有Na2CO310H2O等杂质
D. 步骤④,灼烧时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解正确的是( )
A.摩尔是国际科学界建议采用的一种物理量
B.摩尔是衡量物质所含粒子数目多少的物理量
C.1mol氧含6.02×1023个O2
D.摩尔是物质的量的单位,简称摩,符号为mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应2N2H4 + 2NO2 = 3N2 + 4H2O 中,氧化产物和还原产物的物质的量之比为 ( )
A. 1:1 B. 3:4 C. 4:3 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)物质的量浓度相等的CH3COONa溶液和NaClO溶液pH大小关系为:c(CH3COONa)_____c(NaClO)(填“>”、“<”或“=”)。
(2)H2CO3的电离方程式为:_____。
(3)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:_____。
(4)泡沫灭火器内筒装有Al2(SO4)3溶液,外筒装有NaHCO3溶液。
① Al2(SO4)3溶液呈酸性的原因是:_____。(用离子方程式说明)
② 内、外筒溶液混合后发生反应离子方程式为:_____。
(5)常温下0.1 molL-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变大的是______。
A.c(H+) B.c(H+)·c(OH-)
C. ![]() D.
D.![]()
(6)H+浓度相等、体积相等的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应后,仅有一份溶液中剩余锌,放出氢气的质量相同,则下列说法正确的是 __(填写序号)。
①开始反应时的速率A>B ②放出等量氢气所需要的时间B>A
③参加反应的锌的物质的量A=B ④A中有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl和NaBr的混合溶液中,Na+、Br-、Cl-的物质的量浓度之比不可能出现的是 ( )
A. 3:2:2 B. 5:3:2 C. 5:4:1 D. 3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是( )

A. Cu和浓硝酸 B. CaO和浓氮水
C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭和水蒸气反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式_________________________。
(2)液化石油气的主要成分是丙烷,已知丙烷、CO以及氢气燃烧的热化学方程式分别为:
C3H8(g) +5O2(g) == 3CO2(g) + 4H2O(l) △H= –2220.0 kJ·![]()
CO(g) +1/2O2(g) == CO2(g) △H= –282.6kJ·![]()
2H2(g)+O2(g) == 2H2O(l) △H= –571.6 kJ·![]()
试比较同质量的H2和C3H8燃烧,产生的热量比值约为_______。(计算结果保留小数点后一位数字)
(3)氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用。
请在下图的两个空框中填上循环过程中的反应物和生成物,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。

__________________________、 ___________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com