
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某研究小组拟设计微生物燃料电池将污水中的乙二胺![]() 氧化成环境友好的物质,再利用该装置模拟工业电解法来处理含
氧化成环境友好的物质,再利用该装置模拟工业电解法来处理含![]() 废水,电解过程溶液中发生反应为
废水,电解过程溶液中发生反应为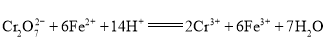 。当电池工作时,下列说法错误的是( )
。当电池工作时,下列说法错误的是( )
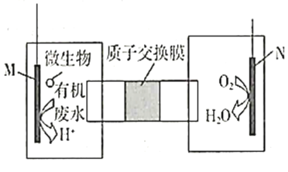
A.Fe棒应与N极相连
B.![]() 透过质子交换膜由右向左移动
透过质子交换膜由右向左移动
C.若溶液中减少了![]()
![]() ,则电路中至少转移
,则电路中至少转移![]() 电子
电子
D.M极电极反应式为H2N(CH2)2NH2+4H2O-16e-=2CO2↑+N2↑+16H+
科目:高中化学 来源: 题型:
【题目】氧化铁和氧化铜的固体混合粉末Xg,高温下用足量的一氧化碳还原,得到金属混合物2.4 g,将生成的二氧化碳气体用足量的澄清石灰水吸收后,产生5 g白色沉淀,则X的值为( )
A.2.45
B.3.20
C.4.00
D.7.40
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式______________;
(2)已知在一定条件下,电解熔融状态的CeO2可制备![]() ,写出阳极的电极反应式:_______。
,写出阳极的电极反应式:_______。
(3)某课题组以上述废玻璃粉末(含有SiO2,Fe2O3,CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。

①过滤得到滤渣B时,需要将其表面杂质洗涤干净,沉淀洗涤的的操作是_______。
②反应①的离子方程式为____________。
③操作I的名称是_____________。
④已知:M[Ce(OH)4]=208g/mol,氧化还原滴定法测定制得的Ce(OH)4产品纯度的流程为:称取0.600gCe(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4标准液滴定,消耗25.00mL标准液。该产品中Ce(OH)4的质量分数为____________(小数点后保留两位),若滴定所用FeSO4溶液己在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度___________(“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:

A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
CO(g)+H2(g) ΔH= +131.3kJ/mol,ΔS= +133.7J/(K·mol)。
①该反应能否自发进行与________________有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是________(填字母,下同)。
a.容器中的压强不变
b.1mol H-H键断裂的同时断裂2mol H-O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是____________________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ/mol)的变化。在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使 c(CH3OH)增大的是___。
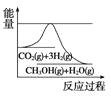
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质、非电解质的说法正确的是:
A.氯气溶于水得氯水,该溶液能导电,因此氯气是电解质
B.CaCO3![]() 饱和溶液导电能力很弱,故CaCO3是弱电解质
饱和溶液导电能力很弱,故CaCO3是弱电解质
C.HF的水溶液中既有H+、F+,又有大量的HF分子,因此HF是弱电解质
D.导电能力弱的溶液肯定是弱电解质的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下氯气和氢气共aL,在光照下充分进行反应,反应后的气体恰好能使bmol 氢氧化钠完全转化成盐,则a、b的关系不可能是下列的( )
A. b<![]() B. b<
B. b<![]() C. b>
C. b>![]() D. b>
D. b>![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物有广泛用途。二氧化氯是一种新型的消毒剂。
①NaClO2中Cl的化合价为____________。
②实验室用氯酸钾与浓盐酸反应制备ClO2,产物除ClO2外,还有Cl2,KCl等,写出该反应的化学方程式 __________。若生成11.2L氯气(标准状况),转移电子数为 _________。
③ClO2和Cl2在消毒时自身均被还原为Cl-,则常温常压下,等体积的ClO2的消毒能力是Cl2的_________倍。
④自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1﹣0.8 mgL-1之间。碘量法可以检测水中ClO2的浓度(不同pH环境中粒子种类如图所示),步骤如下:
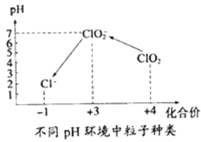
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再将反应后溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(己知:2S2O32-+I2═S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1﹣3。
请问答:
若水样的体积为1.0L,在操作II时消耗了1.0×10-3molL-1的Na2S2O3溶液10mL.则水样中ClO2的浓度是_____ mgL-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com